2015-2016學年福建省龍巖市武平一中高三(上)第11周周練化學試卷
發(fā)布:2024/10/30 12:0:3
一、選擇題(共14小題,每小題3分,滿分42分)
-
1.設NA為阿伏加德羅常數(shù)的數(shù)值,下列說法正確的是( )
A.1L 0.1mol?L-1的氨水中有NA個NH4+ B.常溫常壓下,8g O2含有4NA個電子 C.標準狀況下,22.4L三氯甲烷含有NA個分子 D.1mol Na被完全氧化生成Na2O2,失去2NA電子 組卷:20引用:2難度:0.5 -
2.由硫酸鉀、硫酸鋁和硫酸組成的混合溶液,其中c(H+)=0.1mol/L,c(Al3+)=0.4mol/L,c(SO42-)=0.8mol/L,則c(K+)為( )
A.0.15 mol/L B.0.2 mol/L C.0.3 mol/L D.0.4 mol/L 組卷:786引用:55難度:0.9 -
3.某氯化鎂溶液的密度為1.2g?cm-3,其中鎂離子的質(zhì)量分數(shù)為5%,300mL該溶液中Cl-離子的物質(zhì)的量約為( )
A.0.37 mol B.0.63mol C.0.75mol D.1.5mol 組卷:16引用:2難度:0.9 -
4.下列物質(zhì)依次按照混合物、氧化物、弱電解質(zhì)和非電解質(zhì)的順序排列的一組是( )
A.淀粉、CuO、HClO、Cu B.水玻璃、Na2O?CaO?6SiO2、AgO、SO3 C.KAl(SO4)2?12H2O、KClO3、NH3?H2O、CH3CH2OH D.普通玻璃、H2O、Fe(SCN)3、葡萄糖 組卷:27引用:4難度:0.9 -
5.下列離子方程式書寫錯誤的是( )
A.用FeCl3溶液制備膠體:Fe3++3H2O Fe(OH)3(膠體)+3H+△B.工業(yè)上用過量氨水吸收SO2:SO2+NH3?H2O═HSO3-+NH4+ C.實驗室用稀硝酸浸泡做銀鏡反應實驗的試管:3Ag+4H++NO3-═3Ag++NO↑+2H2O D.用稀硫酸酸化的KMnO4溶液與H2O2反應,證明H2O2具有還原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O 組卷:4引用:1難度:0.7 -
6.下列各組中的微粒在指定溶液中一定能大量共存的是( )
A.c(FeCl3)=1.0mol/L的溶液中: 、Cl-、H+、Na+HCO-3B.常溫下,由水電離出的c(H+)=10-14mol/L溶液中: 、K+、NH+4、CO2-3SO2-4C.加入鋁能產(chǎn)生大量氫氣的溶液中: 、SO2-4、K+、Cl-MnO-4D.常溫下, =0.1 mol/L的溶液中:K+、NH3?H2O、Kwc(H+)、SO2-3NO-3組卷:7引用:2難度:0.7
二、解答題(共4小題,滿分0分)
-
17.實驗研究發(fā)現(xiàn),硝酸發(fā)生氧化還原反應時,硝酸的濃度越稀,對應還原產(chǎn)物中氮元素的化合價越低,甚至產(chǎn)生 NH+4.現(xiàn)有一定量鋁粉和鐵粉的混合物與一定體積某濃度 的稀硝酸充分反應,反應過程中無氣體放出.在反應結束后的溶液中,逐滴加入 5mol?L-1的 NaOH溶液,所加 NaOH 溶液的體積(mL)與產(chǎn)生的沉淀的物質(zhì)的量關系如圖所示.則
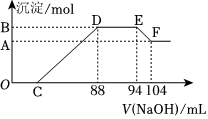
(1)B 與 A 的差值為mol
(2)寫出 DE 段發(fā)生反應的離子方程
(3)原硝酸的物質(zhì)的量是mol
(4)鋁粉和鐵粉的混合物中鋁粉與鐵粉的物質(zhì)的量之比為.組卷:141引用:2難度:0.1 -
18.將7.8gMg、Al合金溶于一定物質(zhì)的量濃度的HCl溶液400mL中,剛好完全反應,經(jīng)檢測合金和鹽酸都無剩余,再向反應后的溶液中加入2mol/L的NaOH溶液后,生成沉淀,如果加入一定量的NaOH溶液后沉淀量最大時,溶液的總體積剛好為合金溶解時的體積的兩倍,假設完全反應 (不考慮體積變化),求(寫出計算過程)
(1)生成的沉淀的最大值是多少?
(2)原合金中Mg的質(zhì)量百分含量(計算結果保留一位小數(shù)點).組卷:9引用:2難度:0.5


