2013-2014學年江蘇省鹽城中學高二(下)暑假化學作業(7)
發布:2024/4/20 14:35:0
一、選擇題
-
1.硝酸被稱為“國防工業之母”是因為它是制取炸藥的重要原料.下列實驗事實與硝酸性質不相對應的一組是( )
A.濃硝酸使紫色石蕊試液先變紅后褪色--酸性和強氧化性 B.不能用稀硝酸與鋅反應制氫氣--強氧化性 C.要用棕色瓶盛裝濃硝酸--不穩定性 D.能使滴有酚酞的氫氧化鈉溶液紅色褪去--強氧化性 組卷:69引用:11難度:0.9 -
 2.NH3是一種重要的化工原料,可以制備一系列物質(如圖).下列說法正確的是( )
2.NH3是一種重要的化工原料,可以制備一系列物質(如圖).下列說法正確的是( )A.NH4Cl和NaHCO3都是常用的化肥 B.NH4Cl、HNO3和Na2CO3受熱時都易分解 C.NH3和NO2在一定條件下可發生氧化還原反應 D.圖中所涉及的反應均為氧化還原反應 組卷:116引用:8難度:0.7 -
3.如圖,利用培養皿探究氨氣的性質。實驗時向NaOH固體上滴幾滴濃氨水,立即用另一表面皿扣在上面,如表中對實驗現象所做的解釋正確的是( )
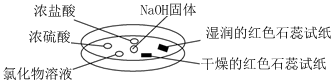
選項 實驗現象 解釋 A 濃鹽酸附近產生白煙 NH3與濃鹽酸揮發的HCl氣體反應產生了NH4Cl固體 B 濃硫酸附近無明顯現象 NH3與濃硫酸不發生反應 C 氯化物溶液變渾濁 該溶液一定是AlCl3溶液 D 干燥紅色石蕊試紙不變色,濕潤的紅色石蕊試紙變藍 NH3是一種可溶性堿 A.A B.B C.C D.D 組卷:119引用:10難度:0.7
二、非選擇題
-
 10.為了證明銅與稀硝酸反應產生一氧化氮,某校同學設計了一個實驗,其裝置如圖所示(加熱裝置和固定裝置均已略去)。A為注射器,B為兩端長短不等的U形管,C是裝有NaOH溶液的燒杯,D處是繞成螺旋狀的銅絲,K1、K2是止水夾。
10.為了證明銅與稀硝酸反應產生一氧化氮,某校同學設計了一個實驗,其裝置如圖所示(加熱裝置和固定裝置均已略去)。A為注射器,B為兩端長短不等的U形管,C是裝有NaOH溶液的燒杯,D處是繞成螺旋狀的銅絲,K1、K2是止水夾。
(1)實驗時,為在D處收集到NO,以便觀察顏色,必須事先在A中吸入一定量的空氣。然后K1(“關閉”或“打開”),打開止水夾K2,從U形管左端注入稀硝酸,當看到時可以確定U形管中空氣已被趕盡,關閉止水夾K2。
(2)然后給裝置B微微加熱,在裝置D處產生無色氣體,其反應的離子方程式為:。
(3)如何證明D處聚集的是NO而不是H2.。
(4)實驗現象觀察完畢,關閉止水夾K1,打開止水夾K2,在重力作用下,U形管右端的紅棕色混合氣體被酸液壓入NaOH溶液中吸收,消除了環境污染。組卷:1引用:1難度:0.6 -
11.(1)實驗室用金屬銅和稀硝酸制取NO的離子方程式:
.
(2)NO是有毒氣體,某學生為防止污染,用分液漏斗和燒杯裝配了一套簡易的、能隨開隨用、隨關隨停的NO氣體發生裝置,如圖Ⅰ所示.
①實驗室若沒有銅絲,而只有小銅粒,在使用上述裝置進行實驗時,可用絲狀材料包裹銅粒以代替銅絲進行實驗,這絲狀材料的成分可以是(填選項編號).
A.鐵 B.鋁 C.銀 D.玻璃 E.聚丙烯塑料
②打開分液漏斗的活塞使反應進行,在分液漏斗中實際看到的氣體是紅棕色的,原因是(填化學方程式)
(3)為了證明銅絲與稀硝酸反應生成的確實是NO,某同學另設計了一套如圖Ⅱ所示制取NO的裝置.反應開始后,可以在U形管右端觀察到無色的NO氣體.
①長玻璃管的作用是.
②讓反應停止的操作方法及原因是.
(4)以下收集NO氣體的裝置(見圖Ⅲ),合理的是(填選項代號) 組卷:37引用:3難度:0.5
組卷:37引用:3難度:0.5


