2022年北京市育才學校高考化學三模試卷
發布:2024/4/20 14:35:0
二、第一部分本部分共14題,每題3分,共42分。在每題列出的四個選項中,選出最符合題目要求的一項。
-
1.下列說法不正確的是( )
A.原子光譜可用于鑒定氫元素 B.電解法可用于冶煉鋁等活潑金屬 C.分餾法可用于提高石油中乙烯的產量 D.焰色試驗可用于區分NaCl和KCl 組卷:45引用:4難度:0.7 -
2.下列關于CH3COOH的化學用語或圖示表達不正確的是( )
A.醋酸溶液呈酸性:CH3COOH?CH3COO-+H+ B.一定條件下,CH3COOH與C2 OH反應能生成H185
C.0.1mol?L-1醋酸溶液中,c(CH3COOH)+c(CH3COO-)=0.1 mol?L -1 D.測定CH3COOH相對分子質量的質譜如圖  組卷:8引用:1難度:0.6
組卷:8引用:1難度:0.6 -
 3.下列各項比較中,正確的是( )
3.下列各項比較中,正確的是( )A.7.8gNa2O2中含有的離子數為0.4NA B.標準狀況下,等體積乙烷和苯,所含分子數相等 C.等物質的量的Fe和Cu分別與足量的Cl2反應,轉移的電子數相等 D.質量相同的H2O和D2O(重水)所含的原子數不相同 組卷:26引用:2難度:0.6 -
4.檢驗下列溶液是否變質,所選試劑合理的是( )
選項 A B C D 溶液 Na2SO3溶液 FeSO4溶液 KI溶液 NaOH溶液 所選試劑 BaCl2溶液 KSCN溶液 AgNO3溶液 高錳酸鉀溶液 A.A B.B C.C D.D 組卷:32引用:2難度:0.5 -
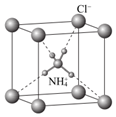 5.NH4Cl的晶胞為立方體,其結構如圖。下列說法不正確的是( )
5.NH4Cl的晶胞為立方體,其結構如圖。下列說法不正確的是( )A.NH4Cl晶體屬于離子晶體 B.NH4Cl晶胞中H—N—H鍵角為90° C.NH4Cl晶體中既有離子鍵又有共價鍵 D.每個Cl-周圍與它最近且等距離的 的數目為8NH+4組卷:270引用:14難度:0.8 -
6.下列離子檢驗利用了氧化還原反應的是( )
選項 待檢驗離子 檢驗試劑 A Fe3+ KSCN溶液 B SO42- 稀鹽酸、氯化鋇溶液 C I- Cl2、淀粉溶液 D NH4+ 濃NaOH溶液、濕潤的紅色石蕊試紙 A.A B.B C.C D.D 組卷:39引用:1難度:0.7
第二部分本部分共5題,共58分。
-
18.SCR和NSR技術可有效降低柴油發動機在空氣過量條件下的NOx排放。
(1)SCR(選擇性催化還原)工作原理:
①尿素[CO(NH2)2]水溶液熱分解為NH3和CO2,該反應的化學方程式:。
②反應器中NH3還原NO2的化學方程式:。
③當燃油中含硫量較高時,尾氣中SO2在O2作用下會形成(NH4)2SO4,使催化劑中毒。用化學方程式表示(NH4)2SO4的形成:。
④尿素溶液濃度影響NO2的轉化,測定溶液中尿素(M=60g?mol-1)含量的方法如下:取a g尿素溶液,將所含氮完全轉化為NH3,所得NH3用過量的v1 mL c1 mol?L-1H2SO4溶液吸收完全,剩余H2SO4用v2mL c2 mol?L-1NaOH溶液恰好中和,則尿素溶液中溶質的質量分數是。
(2)NSR(NOx儲存還原)工作原理:
NOx的儲存和還原在不同時段交替進行,如圖a所示。
①通過BaO和Ba(NO3)2的相互轉化實現NOx的儲存和還原。儲存NOx的物質是。
②用H2模擬尾氣中還原性氣體研究了Ba(NO3)2的催化還原過程,該過程分兩步進行,圖b表示該過程相關物質濃度隨時間的變化關系。第一步反應消耗的H2與Ba(NO3)2的物質的量之比是。
③還原過程中,有時會產生笑氣(N2O)。用同位素示蹤法研究發現笑氣的產生與NO有關。在有氧條件下,15NO與NH3以一定比例反應時,得到的笑氣幾乎都是15NNO.將該反應的化學方程式補充完整:催化劑15NNO+H2O。組卷:1039引用:14難度:0.5 -
19.實驗小組同學為探究Fe2+的性質,進行如下實驗。
[實驗Ⅰ]向2mL0.1mol?L-1FeSO4,溶液中滴加幾滴0.1mol?L-1KSCN溶液,無明顯現象,再滴加幾滴3% H2O2溶液(用H2SO4,酸化至pH=1),溶液顏色變紅。
(1)甲同學通過上述實驗分析Fe2+具有(填“氧化”或“還原“)性。
乙同學查閱資料發現Fe2+與SCN-也可發生反應,生成無色的配合物。為證實該性質,利用FeCO3進行如下實驗。
(2)FeCO3的制備:用過量NH4HCO3溶液與FeSO4溶液反應得到FeCO3,離子方程式為。
[實驗Ⅱ]驗證Fe2+與SCN-發生反應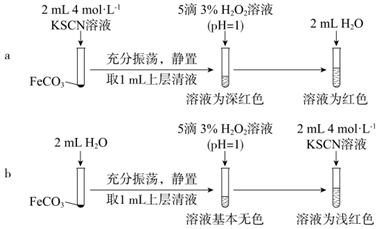
(3)通過實驗b排除了的干擾。
(4)從沉淀溶解平衡角度解釋實驗a和b最終溶液顏色不同的原因是。
丙同學設計實驗進一步證明Fe2+可與SCN-反應。
[實驗Ⅲ]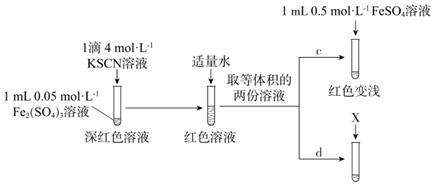
(5)上述實驗中,d為c的對照實驗。
①X為。
②實驗能夠證實Fe2+可與SCN-反應,則應觀察到的現象是。
(6)實驗III中若未加適量水稀釋,則無法通過現象得出結論。推測加水稀釋的目的可能有:使后續實驗顏色變化易于觀察;降低c(Fe3+),。組卷:133引用:3難度:0.6


