2013-2014學年江蘇省泰州市口岸中學高三(下)化學暑假作業
發布:2024/4/20 14:35:0
一、單項選擇題:本題包括10小題,每小題2分,共計20分.每小題只有一個選項符合題意.
-
1.2012年世界環境日的中國主題是:綠色消費,你行動了嗎?下列做法不符合該主題的是( )
A.開發利用太陽能、生物質能等清潔能源 B.推廣垃圾的分類回收,研發各種材料的再生技術 C.減少化石燃料的使用,以降低PM2.5對環境的污染 D.充分開發利用純天然纖維,停止使用各種化學合成材料 組卷:11引用:5難度:0.9 -
2.下列有關化學用語表示不正確的是( )
A.氧的原子結構示意圖: 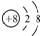
B.Na2O2的電子式: 
C.HClO的結構式:H-O-Cl D.中子數為16的硫離子: S2-3216組卷:25引用:5難度:0.9 -
3.常溫下,下列各組離子在指定溶液中一定能大量共存的是( )
A.無色溶液:K+、Na+、Cu2+、 SO2-4B.c(OH-)=10-13 mol?L-1的溶液:Al3+、 、I-、Cl-NO-3C.水電離產生的c(H+)=10-13 mol?L-1的溶液:Na+、Cl-、 、NO-3SO2-4D.0.1 mol?L-1 FeSO4溶液:K+、 、NH+4、ClO-MnO-4組卷:10引用:6難度:0.9 -
 4.下列說法不正確的是( )
4.下列說法不正確的是( )A.水解反應 +H2O?NH3?H2O+H+達到平衡后,升高溫度平衡正向移動NH+4B.在海輪外殼上鑲入鋅塊,可減緩船體的腐蝕速率 C.明礬能水解生成Al(OH)3膠體,可用作凈水劑 D.在圖所示的反應過程中:A+B-→X的△H<0,X→C的△H>0 組卷:27引用:6難度:0.9 -
5.下列有關物質的性質與應用均正確的是( )
A.MgO的熔點很高,可用于制作耐高溫材料 B.Na2O2是堿性氧化物,具有強氧化性可用于殺菌消毒 C.氨氣是一種堿性氣體,可用P2O5或無水氯化鈣干燥 D.SO2和Cl2都能使品紅溶液褪色,兩者等體積混合可以增強漂白能力 組卷:26引用:4難度:0.9 -
6.用如圖實驗裝置和方法進行相應實驗,能達到實驗目的的是( )
A. 
分離乙醇與乙酸B. 
向容量瓶中轉移液體C. 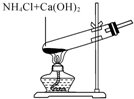
制備少量氨氣D. 
分餾石油組卷:6引用:1難度:0.9 -
7.下列物質的轉化在給定條件下能實現的是( )
①SiO2Na2SiO3NaOHH2SiO3HCl溶液
②FeFe2O3O2點燃Fe2(SO4)3H2SO4
③BaSO4BaCO3飽和Na2CO3溶液BaCl2HCl溶液
④AlCl3Al電解NaAlO2NaOH
⑤HCHOHCOOHO2HCOOCH3.CH3OHH2SO4、△A.①④⑤ B.②③④ C.②④⑤ D.①③⑤ 組卷:36引用:5難度:0.7
三、非選擇題(70分)
-
20.“神七”登天譜寫了我國航天事業的新篇章.火箭升空需要高能燃料,經常是用肼(N2H4)作為燃料,N2O4作氧化劑.
(1)已知:N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ?mol-1
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.0kJ?mol-1
2NO2(g)═N2O4(g)△H=-52.7kJ?mol-1
請寫出氣態肼在氣態四氧化二氮中燃燒生成氮氣和氣態水的熱化學方程式:.
(2)工業上可用次氯酸鈉與過量的氨反應制備肼,該反應的化學方程式為.
(3)一定條件下,在2L密閉容器中起始時投入2mol NH3和4mol O2,發生反應:
4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0,測得平衡時的數據如下表:
①在T1時,若經過10min反應達到平衡,則10min內反應的平均速率v(NH3)=有關物質的物質的量/mol n(NO) n(H2O) 溫度T1 1.6 2.4 溫度T2 1.2 1.8 .
②T1和T2的大小關系是T1T2(填“>”“<”或“=”).
(4)在載人航天器的生態系統中,不僅要求分離去除CO2,還要求提供充足的O2.某種電化學裝置可實現如下轉化:2CO2═2CO+O2,CO可用作燃料.已知該裝置的陽極反應為:4OH--4e-═O2↑+2H2O,則陰極反應為.
有人提出,可以設計反應2CO═2C+O2(△H>0)來消除CO的污染,請你判斷該反應是否能自發進行并說明理由?答:.
(5)某空間站能量轉化系統的局部如圖所示,其中的燃料電池采用KOH溶液作電解液.
如果某段時間內,氫氧儲罐中共收集到33.6L氣體(已折算成標準狀況),則該段時間內水電解系統中轉移電子的物質的量為mol.組卷:24引用:3難度:0.5 -
 21. 物質結構與性質
21. 物質結構與性質
短周期非金屬元素A、B、C的核電荷數依次增大,A原子的外圍電子排布式為ns2np2,C是地殼中含量最多的元素.元素D、E都位于第四周期,其中E的核電荷數為29,D原子的核外未成對電子數在同周期中是最多的.請用對應的元素符號或化學式填空:
(1)元素A、B、C的第一電離能由小到大的順序為.
(2)已知(AB)2分子中鍵與鍵之間的夾角為180°,并有對稱性,且每個原子的最外層電子均滿足8電子結構,則其結構式為,1mol該分子中含有的π鍵的數目為.
(3)基態D原子的外圍電子排布式為.化合物DO2Cl2的熔點是-96.5℃,沸點是117℃,則固態DO2Cl2屬于晶體.
(4)已知元素E的氫化物的晶胞結構如圖所示,則其化學式為.組卷:13引用:3難度:0.5


