2022-2023學年天津市第二南開中學高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題:(每小題只有一個正確選項,共60分,請將答案填涂在答題紙上)
-
1.下列關于有效碰撞理論與影響速率因素之間關系不正確的是( )
A.活化分子間所發生的部分碰撞為有效碰撞 B.增大反應物濃度能夠增大單位體積內的活化分子數,化學反應速率增大 C.升高溫度,活化分子百分數增大,化學反應速率增大 D.選用適當的催化劑,分子運動加快,增加了碰撞頻率,故反應速率增大 組卷:45引用:3難度:0.6 -
2.下列變化或者選擇的條件符合勒夏特列原理的是( )
A.FeCl3溶液和KSCN溶液混合后,加入KCl固體,溶液顏色變淺 B.合成氨工業采用高壓 C.硫酸工業中,二氧化硫轉化為三氧化硫選用常壓條件 D.合成氨工業采用500度左右的溫度 組卷:22引用:1難度:0.7 -
3.在298K、100kPa時,已知:
2H2O(g)═O2(g)+2H2(g)ΔH1
Cl2(g)+H2(g)═2HCl(g)ΔH2
2Cl2(g)+2H2O(g)═4HCl(g)+O2(g)ΔH3
則ΔH3與ΔH1和ΔH2間的關系正確的是( )A.ΔH3═2ΔH1+ΔH2 B.ΔH3═ΔH1-ΔH2 C.ΔH3═ΔH1-2ΔH2 D.ΔH3═ΔH1+2ΔH2 組卷:137引用:2難度:0.9 -
4.某化學小組查閱資料獲得25℃和101kPa下的鍵能數據:
則反應N2(g)+3H2(g)═2NH3(g)的反應熱為( )化學鍵 N≡N H-H N-H 鍵能/(kJ?mol-1) 946 436 391 A.-92kJ?mol-1 B.+180kJ?mol-1 C.+92kJ?mol-1 D.-180kJ?mol-1 組卷:16引用:1難度:0.6 -
5.下列說法或表示法正確的是( )
A.H2(g)+Cl2(g)=2HCl(g)要在光照和點燃條件下才反應,所以△H>0,△S<0 B.由C(s,石墨)=C(s,金剛石)△H=+1.19kJ?mol-1可知,金剛石比石墨穩定 C.在稀溶液中:H+(aq)+OH-(aq)=H2O(1);△H=-57.3kJ?mol-1,若將0.5mol/L的H2SO4溶液1mol/L的NaOH溶液等體積混合,放出的熱量等于57.3kJ D.乙醇的燃燒熱△H=-1366.8kJ?mol-1,在25℃、101kPa時,92g乙醇充分燃燒后放出2733.6kJ熱量 組卷:42引用:3難度:0.7 -
 6.一定溫度下,X、Y、Z三種氣體在某恒容密閉容器中發生反應,其中氣體的物質的量變化曲線如圖所示。下列說法正確的是( )
6.一定溫度下,X、Y、Z三種氣體在某恒容密閉容器中發生反應,其中氣體的物質的量變化曲線如圖所示。下列說法正確的是( )A.Q點Y的正反應速率和逆反應速率相等 B.從開始到達到平衡時用X表示的平均反應速率是0.2mol?L-1?min-1 C.該反應的化學方程式可表示為:3X(g)+Z(g)?2Y(g) D.達到平衡后,再充入氬氣,反應速率增大 組卷:24引用:3難度:0.7 -
7.我國科學家使用雙功能催化劑催化水煤氣變換反應:CO(g)+H2O(g)═CO2(g)+H2(g)ΔH<0,在低溫下獲得高轉化率與高反應速率,反應過程示意圖如圖,下列說法正確的是( )
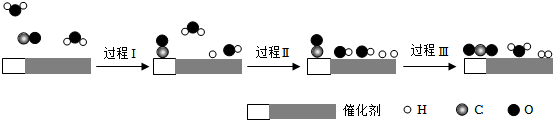
A.過程Ⅰ、過程Ⅱ均為放熱過程 B.圖中顯示:起始時的2個H2O都參與了反應過程 C.過程Ⅲ只生成了極性共價鍵 D.使用催化劑降低了水煤氣變換反應的ΔH 組卷:27引用:2難度:0.7 -
 8.在不同條件下,用O2氧化一定濃度FeCl2溶液的過程中所測得的實驗數據如圖所示。下列分析或推測不合理的是( )
8.在不同條件下,用O2氧化一定濃度FeCl2溶液的過程中所測得的實驗數據如圖所示。下列分析或推測不合理的是( )A.0~6h內,Fe2+的氧化率隨時間延長而逐漸增加 B.由曲線②和③可知,pH越大,Fe2+的氧化速率越快 C.由曲線①和③可知,溫度越高,Fe2+的氧化速率越快 D.氧化過程的離子方程式為4Fe2++O2+4H+═4Fe3++2H2O 組卷:75引用:6難度:0.7
二、非選擇題(總計40分,請將答案寫在答題紙上)
-
23.Ⅰ.水在25℃和95℃時電離平衡曲線如圖。
(1)已知在25℃時,將pH═12的NaOH溶液與pH═2的H2SO4溶液均升溫至35℃,兩溶液pH變化分別為(填字母)。
A.增加、減小
B.增加、增加
C.減小、不變
D.不變、減小
(2)在曲線B所對應的溫度下,將pH═9的NaOH溶液與pH═4的H2SO4溶液混合,若所得混合溶液的pH═6,則NaOH溶液與H2SO4溶液的體積比為。
Ⅱ.通過下列反應制備甲醇:CO(g)+2H2(g)?CH3OH(g)。在一容積可變的密閉容器中充入10molCO和20molH2,CO的平衡轉化率隨溫度(T)、壓強(P)的變化如圖所示。
(3)比較A、B兩點壓強大小:P(A)P(B)(填“>”、“<”或“═”)。
(4)若達到化學平衡狀態A時,容器的體積為20L。如果反應開始時仍充入10molCO和20molH2,則在平衡狀態B時容器的體積為L。 組卷:16引用:1難度:0.5
組卷:16引用:1難度:0.5 -
24.常溫下,HNO2的電離平衡常數Ka═2.6×10-4。亞硝酸鈉(NaNO2)是一種重要的食品添加劑,由于其外觀及味道都與食鹽非常相似,誤食工業用鹽造成食物中毒的事件時有發生。
Ⅰ.亞硝酸鈉有毒,不能隨意丟棄,實驗室一般將其與飽和氯化銨溶液共熱使之轉化成無毒無公害的物質,其產物之一為無色無味氣體,則反應的化學方程式為。
Ⅱ.為了測定樣品中亞硝酸鈉的含量,稱取4.0g樣品溶于水配成250mL溶液,取25.00mL溶液于錐形瓶中,用0.10mol?L-1的酸性KMnO4溶液進行滴定,實驗所得數據如下表。
(1)第一組實驗數據出現較明顯異常,造成異常的原因可能是滴定次數 1 2 3 4 KMnO4溶液體積/mL 20.60 20.02 20.00 19.98 (填字母序號)。
a.酸式滴定管用蒸餾水洗凈后未用標準液潤洗
b.滴定前滴定管尖嘴中有氣泡,滴定后滴定管尖嘴無氣泡
c.判斷終點時,滴入一滴酸性KMnO4溶液,錐形瓶內溶液呈淺紅色,振蕩后立即褪色
d.觀察滴定終點時俯視讀數
(2)KMnO4溶液應用滴定管盛裝(填“酸式”或者“堿式”),滴定過程中,眼睛應注視;
(3)根據表中數據進行計算,所制得的固體中亞硝酸鈉的質量分數為。組卷:14引用:1難度:0.5


