2022年天津市新華中學高考化學一模試卷
發布:2024/4/20 14:35:0
一、選擇題(本大題共12小題,每題只有一個正確答案,每小題3分,共36分)
-
1.化學與社會、科學、技術、生活等密切相關,下列說法正確的是( )
A.“凡引水種鹽,待夏秋之交,南風大起,則一宵結成”該過程屬于蒸發結晶 B.“天和”核心艙其腔體使用的氮化硼陶瓷基復合材料屬于傳統無機非金屬材料 C.“青蒿一握,以水二升漬,絞取汁”,屠呦呦對青蒿素的提取屬于化學變化 D.“一帶一路”是“絲綢之路經濟帶”和“21世紀海上絲綢之路”的簡稱.絲綢的主要成分是天然纖維素,屬于高分子化合物 組卷:53引用:1難度:0.7 -
2.下列性質的比較,不能用元素周期律解釋的是( )
A.酸性:H2SO4<HClO4 B.金屬性:Na>Al C.熱穩定性:Na2CO3>NaHCO3 D.氫化物的穩定性:H2S<H2O 組卷:74引用:1難度:0.7 -
3.光氣(COCl2)是一種重要的有機合成中間體,有劇毒,光氣與氨氣反應的化學方程式為:COCl2+4NH3=CO(NH2)2+2NH4Cl。下列有關說法不正確的是( )
A.NH4Cl中含有離子鍵和共價鍵 B.Cl原子的原子結構示意圖: 
C.CO(NH2)2的球棍模型: 
D.COCl2的電子式為: 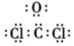 組卷:69引用:4難度:0.6
組卷:69引用:4難度:0.6 -
4.下列離子方程式書寫正確的是( )
A.Na與H2O反應:2Na+2H+═2Na++H2↑ B.向NH4Al(SO4)2溶液滴入過量NaOH溶液:Al3++4OH-═AlO2-+2H2O C.鐵絲與CuSO4溶液反應:Fe+Cu2+═Fe2++Cu D.將H2C2O4溶液(弱酸)滴入酸性KMnO4溶液:5C2O42-+2MnO4+16H+═2Mn2++10CO2↑+8H2O 組卷:70引用:4難度:0.7 -
5.利用下列裝置進行實驗,能達到實驗目的的是( )
A. 
配制0.10mol?L-1 NaCl(aq)B. 
收集SO2并吸收尾氣C. 
制取C2H4D. 
熱干MnCl2溶液制MnCl2?4H2O組卷:97引用:4難度:0.5
二、填空題(本大題共4小題,共64分)
-
15.氮化鍶(Sr3N2)是工業上生產熒光粉的原材料。已知:鍶與氮氣在加熱條件下可生成氮化鍶,氮化鍶遇水劇烈反應產生氨氣。

Ⅰ.利用裝置A和B制備Sr3N2
(1)Sr在元素周期表中的位置是。
(2)實驗裝置中玻璃管之間需用橡皮管連接,其連接方法是先將,然后稍稍用力即可把玻璃管插入橡皮管中。
(3)裝置A中儀器b的名稱為,a導管的作用是;裝置B中廣口瓶盛放的試劑是(填名稱)。
(4)實驗時先點燃裝置處酒精燈(填“A”或“B”),一段時間后,點燃另一只酒精燈;由裝置A制備N2的化學方程式為。
Ⅱ.測定Sr3N2產品的純度
稱取6.0g產品,放入干燥的三頸瓶中,然后加入蒸餾水,通入水蒸氣,將產生的氨全部蒸出,用200.00mL1.0000mol/L的鹽酸標準溶液完全吸收(吸收液體體積變化忽略不計)。從燒杯中量取20.00mL的吸收液放入錐形瓶中,用1.0000mol/LNaOH標準溶液滴定過剩的HCl,到終點時消耗16.00mLNaOH溶液(圖中夾持裝置略)。
(5)三頸燒瓶中發生反應產生氨氣的化學方程式為。
(6)產品純度為(精確到0.1%)。
(7)下列實驗操作可能使氮化鍶(Sr3N2)測定結果偏低的是(填標號)。
A.錐形瓶洗滌干凈后未干燥,直接裝入待測液
B.滴定時未用NaOH標準溶液潤洗滴定管
C.滴定前滴定管尖嘴處有氣泡,滴定結束后氣泡消失
D.讀數時,滴定前平視,滴定后俯視組卷:62引用:4難度:0.6 -
 16.工業煙氣中的SO2嚴重污染環境,可用多種方法進行脫除。
16.工業煙氣中的SO2嚴重污染環境,可用多種方法進行脫除。
(1)H2O2氧化法。
H2O2可以將SO2氧化生成H2SO4,由于H2O2儲存過程可能發生分解反應:2H2O2(aq)=2H2O(l)+O2(g)△H<0。某興趣小組研究I-催化分解H2O2歷程如圖1:
第一步:H2O2(aq)+I-(aq)=IO-(aq)+H2O(l)△H>0慢反應
第二步:△H<0 快反應
請根據I-催化H2O2的分解反應歷程補充剩余的能量示意圖。
(2)ZnO水懸濁液吸收SO2。
已知:室溫下,ZnSO3微溶于水,Zn(HSO3)2易溶于水。向ZnO水懸濁液中勻速緩慢通入SO2,在開始吸收的40min內,SO2吸收率、溶液pH均經歷了從幾乎不變到迅速降低的變化,如圖2。溶液pH幾乎不變的階段,主要產物是(填化學式);SO2吸收率迅速降低階段,主要反應的離子方程式為。
(3)SO2經富集后可用于制備硫酸。現向某密閉容器中充入1molSO2、1molO2在催化條件下發生反應:2SO2+O22SO3,SO2的平衡轉化率與反應溫度、壓強的關系如圖3所示。催化劑加熱
①圖中A、B、C三點逆反應速率由大到小的順序為;若600℃、aMPa時,經過20min達平衡,則用SO3表示的反應速率v(SO3)=mol/min。
②實際工業生產時選擇A點生產條件而非B點,原因是。
③C點對應的Kp為MPa-1(寫出關于a的表達式,保留一位小數,Kp為用分壓表示的化學平衡常數,分壓=總壓×物質的量分數)。組卷:83引用:4難度:0.5


