2021-2022學年甘肅省張掖市高二(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本大題共20小題,第1~10題,每小題2分,第11~20題,每小題2分,共50分。在每小題給出的四個選項中,只有一個選項符合題目要求)
-
1.工業合成氨的反應原理為:N2(g)+3H2(g)?2NH3(g)ΔH<0,下列措施既能加快反應速率又能提高產率的是( )
A.升高溫度 B.分離出NH3 C.增大壓強 D.使用催化劑 組卷:151引用:9難度:0.7 -
2.向純水中加入少量NaHSO4固體,當溫度不變時,則該溶液中( )
A.水電離出的c(H+) 減小 B.c(OH-) 與 c(H+) 的乘積增大 C.c(H+ ) 減小 D.c(OH-) 增大 組卷:93引用:4難度:0.7 -
3.下列說法中正確的是( )
A.一定條件下,將0.5molN2和1.5molH2置于密閉的容器中充分反應生成NH3(g),放熱19.3kJ,其熱化學方程式為N2(g)+3H2(g)?2NH3(g)ΔH=-38.6kJ?mol-1 B.2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g)在低溫下能自發進行,則該反應ΔH>0 C.HCl和NaOH反應的中和熱ΔH=-57.3kJ?mol-1,則1mol硫酸與足量氨水反應放熱為114.6kJ D.H2(g)的燃燒熱是285.8kJ?mol-1,則2H2O(l)═2H2(g)+O2(g)反應的ΔH=+571.6kJ?mol-1 組卷:25引用:1難度:0.5 -
4.相同體積的pH=3的鹽酸溶液和醋酸溶液分別跟足量的鎂完全反應,下列說法正確的是( )
A.醋酸溶液產生較多的氫氣 B.鹽酸溶液產生較多的氫氣 C.兩者產生等量的氫氣 D.無法比較兩者產生氫氣的量 組卷:72引用:2難度:0.7 -
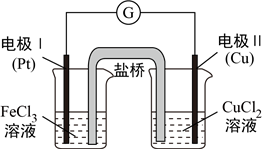 5.如圖是某同學設計的原電池裝置,下列敘述中正確的是( )
5.如圖是某同學設計的原電池裝置,下列敘述中正確的是( )A.電極I上發生還原反應,作原電池的負極 B.電極II的電極反應式為:Cu2++2e-=Cu C.該原電池的正極電極反應式為:Fe3++e-=Fe2+ D.鹽橋中裝有含氯化鉀的瓊脂,其作用是傳遞電子 組卷:78引用:4難度:0.7 -
6.配制FeCl3溶液時,為防止出現渾濁,可向該溶液中加入少量( )
A.鐵 B.鹽酸 C.氯化鈉 D.氫氧化鈉 組卷:75引用:8難度:0.9 -
7.下列與鹽的水解有關的是( )
①NH4Cl與ZnCl2溶液可作焊接金屬中的除銹劑 ②用NaHCO3與Al2(SO4)3兩種溶液可作泡沫滅火劑 ③草木灰與銨態氮肥不能混合施用 ④實驗室盛放Na2CO3溶液的試劑瓶不能用磨口玻璃塞.A.①②③ B.②③④ C.①②③④ D.①④ 組卷:61引用:4難度:0.9 -
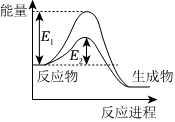 8.NO和CO都是汽車尾氣中的有害物質,它們能緩慢的發生反應,反應的化學方程式為2CO(g)+2NO(g)?N2 (g)+2CO2(g),反應過程中的能量變化如圖所示。下列說法不正確的是( )
8.NO和CO都是汽車尾氣中的有害物質,它們能緩慢的發生反應,反應的化學方程式為2CO(g)+2NO(g)?N2 (g)+2CO2(g),反應過程中的能量變化如圖所示。下列說法不正確的是( )A.該反應的△H<0能量 B.E1和E2分別表示無、有催化劑時反應的活化能 C.增大壓強可減小反應的活化能 D.適當升高溫度可加快反應速率 組卷:72引用:3難度:0.5
二、非選擇題(本題包括4小題,共50分)
-
 24.研究碳、氮、硫等元素化合物的性質或轉化對建設生態文明、美麗中國具有重要意義,請按要求回答下列問題。
24.研究碳、氮、硫等元素化合物的性質或轉化對建設生態文明、美麗中國具有重要意義,請按要求回答下列問題。
Ⅰ.H2S是石油化工行業廣泛存在的污染性氣體,但同時也是重要的氫源和硫源,工業上可以采取多種方式處理。
(1)已知:2H2S(g)+3O2(g)═2SO2(g)+2H2O(l)ΔH1=akJ?mol-1
S(s)+O2(g)═SO2(g)ΔH2=bkJ?mol-1
則空氣氧化脫除H2S反應2H2S(g)+O2(g)═2S(s)+2H2O(l)的ΔH=kJ?mol-1。
(2)H2S與CO2在高溫下發生反應:H2S(g)+CO2(g)?COS(g)+H2O(g)。在340℃時,將1molCO2與1molH2O充入2L的空鋼瓶中。該反應平衡后H2O(g)的物質的量分數為0.3,反應平衡常數K=。
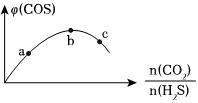
(3)若將H2S和CO2按不同比例投入一密閉容器中發生上述反應,反應達到平衡時,COS的體積分數隨H2S和CO2的投料比的變化曲線如圖所示,則b點時,平衡體系中S、C原子個數比接近;a、b、c三點CO2的轉化率最大的是。組卷:1引用:1難度:0.5 -
25.如圖是一個電化學過程的示意圖.
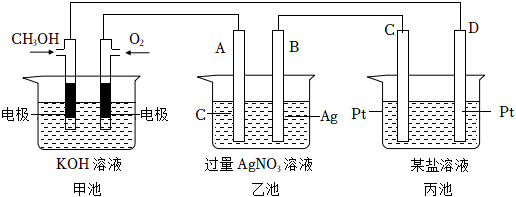
請回答下列問題:
(1)圖中甲池是(填“原電池”“電解池”或“電鍍池”).
(2)A(石墨)電極的名稱是(填“正極”“負極”“陰極”或“陽極”).
(3)寫出通入CH3OH的電極的電極反應式
(4)乙池中反應的化學方程式為當乙池中B(Ag)極質量增加5.4g,甲池中理論上消耗O2的體積為L(標準狀況),此時丙池中某電極析出1.6g某金屬,則丙池中的某鹽溶液可能是
A.MgSO4
B.CuSO4
C.NaCl
D.AgNO3組卷:113引用:10難度:0.3


