2012-2013學(xué)年江西省贛州市信豐中學(xué)高二(上)模塊檢測化學(xué)試卷(化學(xué)反應(yīng)原理)
發(fā)布:2024/4/20 14:35:0
一、選擇題
-
1.升高溫度,下列數(shù)據(jù)不一定增大的是( )
A.化學(xué)反應(yīng)速率v B.KNO3的溶解度S C.化學(xué)平衡常數(shù)K D.水的離子積常數(shù)KW 組卷:132引用:34難度:0.9 -
2.下列過程表達式中,屬于電離方程式的是( )
A.HCO3-+H2O?H2CO3+OH- B.NH3?H2O?NH4++OH- C.NH3+H+=NH4+ D.HCO3-+OH-=H2O+CO32- 組卷:128引用:11難度:0.7 -
3.已知;(NH4)2CO3(s)═NH4HCO3(s)+NH3(g)△H=+74.9kJ?mol-1,下列說法中正確的是( )
A.該反應(yīng)中熵變、焓變皆大于0 B.該反應(yīng)是吸熱反應(yīng),因此一定不能自發(fā)進行 C.碳酸鹽分解反應(yīng)中熵增加,因此任何條件下所有碳酸鹽分解一定自發(fā)進行 D.能自發(fā)進行的反應(yīng)一定是放熱反應(yīng),不能自發(fā)進行的反應(yīng)一定是吸熱反應(yīng) 組卷:235引用:50難度:0.9 -
4.下列說法中,正確的是( )
A.某物質(zhì)的溶解性為難溶,則該物質(zhì)的溶解度為0 B.某離子被沉淀完全是指該離子在溶液中的濃度為0 C.沉淀的生成、溶解和轉(zhuǎn)化其實質(zhì)都是沉淀溶解平衡的移動 D.一般來說,溶解度小的沉淀容易轉(zhuǎn)化為溶解度大的沉淀 組卷:33引用:5難度:0.9 -
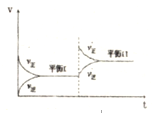 5.恒溫密閉容器中,某反應(yīng)的化學(xué)反應(yīng)速率隨時間變化關(guān)系如圖所示,下列說法不符合該圖示的是( )
5.恒溫密閉容器中,某反應(yīng)的化學(xué)反應(yīng)速率隨時間變化關(guān)系如圖所示,下列說法不符合該圖示的是( )A.達到平衡時,正逆反應(yīng)速率相等 B.增大反應(yīng)物的濃度,反應(yīng)由平衡I變化到平衡Ⅱ C.反應(yīng)達到平衡I以后,減小反應(yīng)物濃度,平衡移動到Ⅱ D.反應(yīng)達到平衡II時的化學(xué)反應(yīng)速率比平衡I時的大 組卷:139引用:13難度:0.7 -
6.下列說法正確的是( )
A.某溫度時,pH=6的純水,含10-6molOH-離子 B.含10.6gNa2CO3溶液中,所含陰離子總數(shù)等于0.1mol C.VLamol/LFeCl3溶液中,若Fe3+離子數(shù)目為1mol,則Cl-離子數(shù)目大于3mol D.電解精煉粗銅時,每轉(zhuǎn)移1mol電子,陽極上溶解的Cu原子數(shù)必為0.5mol 組卷:46引用:4難度:0.7
二、非選擇題
-
18.已知2X2(g)+Y2(g)?2Z(g)△H=-akJ?mol-1(a>0),在一個容積固定的容器中加入2mol X2和1mol Y2,在500℃時充分反應(yīng)達平衡后Z的濃度為W mol?L-1,放出熱量bkJ.
(1)此反應(yīng)平衡常數(shù)表達式為;若將溫度降低到300℃,則反應(yīng)平衡常數(shù)將(填增大、減少或不變).
(2)若原來容器中只加入2mol Z,500℃充分反應(yīng)達平衡后,吸收熱量ckJ,則Z濃度W mol?L-1(填“>”、“<”或“=”),a、b、c之間滿足關(guān)系(用代數(shù)式表示).
(3)若將上述容器改為恒壓容器(反應(yīng)器開始體積相同),相同溫度下起始加入2molX2和1molY2達到平衡后,Y2的轉(zhuǎn)化率將(填“變大”、“變小”或“不變”).組卷:33引用:3難度:0.5 -
19.CuSO4溶液是中學(xué)化學(xué)及工農(nóng)業(yè)生產(chǎn)中常見的一種試劑.
(1)某同學(xué)配制CuSO4溶液時,需加入一定量的硫酸溶液,用離子方程式說明其原因是.
(2)該同學(xué)利用制得的CuSO4溶液,進行以下實驗探究.
①圖一是根據(jù)反應(yīng)Zn+CuSO4=Cu+ZnSO4設(shè)計成的鋅銅原電池.電解質(zhì)溶液甲是(填“ZnSO4”或“CuSO4”)溶液;Cu極的電極反應(yīng)式是.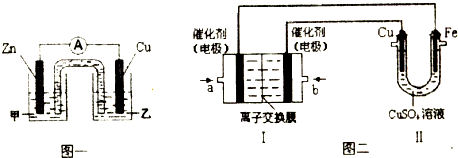
②圖二中,I是甲烷燃料電池(電解質(zhì)溶液為KOH溶液)的結(jié)構(gòu)示意圖,該同學(xué)想在II中實現(xiàn)鐵上鍍銅,則b處通入的是(填“CH4”或“O2”),a處電極上發(fā)生的電極反應(yīng)式是.若把II中電極均換為惰性電極,電解時的化學(xué)反應(yīng)方程式為.若把II中電極均換為惰性電極,電解液換為含有0.04molCuSO4和0.04molNaCl的混合溶液400mL,當(dāng)陽極產(chǎn)生的氣體為672mL(標(biāo)準(zhǔn)狀況下)時,溶液的pH=(假設(shè)電解后溶液體積不變).
(3)將藍礬(CuSO4?5H2O)、生石灰和水按一定比例混合,即可得到波爾多液(殺菌劑),其有效成分為難溶的堿式硫酸銅[xCuSO4?yCu(OH)2].為測定某堿式硫酸銅的組成進行了如下實驗:取等質(zhì)量的堿式硫酸銅樣品兩份,一份滴加稀鹽酸至恰好完全溶解,另一份高溫灼燒后只得到CuO固體.所得數(shù)據(jù)顯示n(HCl):n(CuO)=3:2,則該堿式硫酸銅的化學(xué)式中x:y=.組卷:41引用:3難度:0.5


