2021-2022學(xué)年重慶外國(guó)語(yǔ)學(xué)校、西南大學(xué)附中聯(lián)考高三(上)第一次診斷化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題:本題共14道小題,每小題3分,共42分。在每小題給出的四個(gè)選項(xiàng)中,只有一項(xiàng)是符合題目要求的。
-
1.2021年我國(guó)取得讓世界矚目的科技成果,化學(xué)功不可沒(méi),下列說(shuō)法錯(cuò)誤的是( )
A.“嫦娥五號(hào)”運(yùn)載火箭用液氧液氫推進(jìn)劑,產(chǎn)物對(duì)環(huán)境無(wú)污染 B.我國(guó)成功研制出多款新冠疫苗,采用冷鏈運(yùn)輸疫苗,以防止蛋白質(zhì)變性 C.“天和核心艙”電推進(jìn)系統(tǒng)中的腔體采用氮化硼陶瓷屬于新型無(wú)機(jī)非金屬材料 D.二氧化碳到淀粉的人工全合成技術(shù),可減少向空氣中排放CO2形成酸雨 組卷:27引用:4難度:0.7 -
2.下列化學(xué)用語(yǔ)表示正確的是( )
A.鈣離子的結(jié)構(gòu)示意圖: 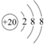
B.中子數(shù)為2的氫核素: H21C.甲酸乙酯的鍵線式: 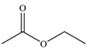
D.H2O2的電子式: 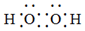 組卷:0引用:1難度:0.8
組卷:0引用:1難度:0.8 -
3.下列離子方程式正確的是( )
A.向FeCl3溶液通入足量H2S:2Fe3++3H2S═2FeS↓+S↓+6H+ B.Na2S2O3溶液與稀硫酸的反應(yīng):3S2O32-+2H+═4S↓+2SO42-+H2O C.用Na2CO3溶液吸收少量Cl2:2CO32-+Cl2+H2O═2HCO3-+Cl-+ClO- D.NH4Al(SO4)2溶液與足量的Ba(OH)2溶液反應(yīng):Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O 組卷:3引用:1難度:0.6 -
4.以NA表示阿伏加德羅常數(shù)的值,下列說(shuō)法正確的是( )
A.12gNaHSO4晶體中陰、陽(yáng)離子總數(shù)為0.2NA B.18g液態(tài)水完全變成水蒸氣,該過(guò)程破壞共價(jià)鍵的數(shù)目為2NA C.常溫下,pH=1的CH3COOH溶液中,體系中H+的數(shù)目為0.1NA D.常溫下,100mL18mol/L濃硫酸加入足量的Cu,該過(guò)程轉(zhuǎn)移電子數(shù)為1.8NA 組卷:0引用:1難度:0.7 -
5.已知:2SO2(g)+O2(g)
2SO3(g)△H=-197.8kJ?mol-1。下列說(shuō)法正確的是( )催化劑△A.高溫條件有利于該反應(yīng)自發(fā)進(jìn)行 B.該反應(yīng)達(dá)到平衡狀態(tài)時(shí):2v(SO2)═v(O2) C.工業(yè)生產(chǎn)中選擇400℃~500℃進(jìn)行該反應(yīng)是為了提高反應(yīng)速率及原料的平衡轉(zhuǎn)化率 D.該反應(yīng)每生成1molSO3可釋放98.9kJ熱量,工業(yè)上利用熱交換器將放出的熱量來(lái)預(yù)熱反應(yīng)前的原料氣(SO2和O2),實(shí)現(xiàn)能量的循環(huán)利用 組卷:2引用:1難度:0.7 -
6.我國(guó)科學(xué)院化學(xué)研究所報(bào)道了化合物1催化CO2氫化機(jī)理。由化合物1(催化劑,固體)→化合物2(中間產(chǎn)物,固體)過(guò)程的機(jī)理和相對(duì)能量曲線如圖所示(已知1eV=1.6×10-19J)。下列說(shuō)法錯(cuò)誤的是( )
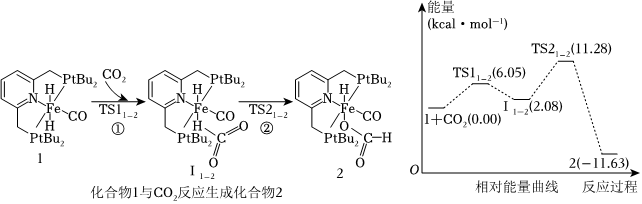
A.該過(guò)程中Fe形成的共價(jià)鍵數(shù)目沒(méi)有變 B.圖中11-2與化合物2互為同分異構(gòu)體 C.過(guò)程②為化合物1→化合物2過(guò)程的決速步驟 D.過(guò)程①的熱化學(xué)方程式為:1(s)+CO2(g)=11-2(s)ΔH=+2.08kJ?mol-1 組卷:8引用:1難度:0.7
(二)選考題:共15分。請(qǐng)考生從第18題和第19題中任選一道作答。如果多做,則按所做的第一題計(jì)分。【化學(xué)—選修3:物質(zhì)結(jié)構(gòu)與性質(zhì)】(15分)
-
18.銅及其化合物在科學(xué)研究和工業(yè)生產(chǎn)中具有許多用途,請(qǐng)回答下列問(wèn)題:
(1)畫出基態(tài)Cu原子的價(jià)電子排布式。
(2)已知高溫下Cu2O比CuO穩(wěn)定,從核外電子排布角度解釋高溫下Cu2O更穩(wěn)定的原因。
(3)配合物[Cu(NH3)2]OOCCH3中碳原子的雜化類型是,配體的空間構(gòu)型為。C、N、O三種元素的第一電離能由大到小的順序是(用元素符號(hào)表示)。
(4)銅晶體中銅原子的堆積方式如圖1所示,則晶體銅原子的堆積方式為。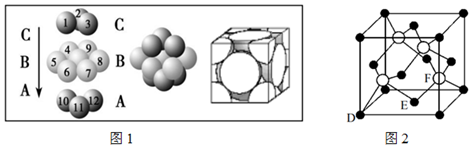
(5)M原子的價(jià)電子排布式為3s23p5,銅與M形成化合物的晶胞如圖2所示(白球代表銅原子)。
①該晶體的化學(xué)式為。
②原子坐標(biāo)參數(shù),表示晶胞內(nèi)部個(gè)原子的相對(duì)位置。圖2晶胞中,其中原子坐標(biāo)參數(shù)D為3s23p5;E為。則F原子的坐標(biāo)參數(shù)為(12,12,0)。
③已知該晶體的密度為ρg/cm3,阿伏加德羅常數(shù)的值為NA,則該晶體中Cu原子和M原子之間的最短距離為pm(寫出計(jì)算式)。組卷:4引用:1難度:0.7
【化學(xué)—選修5:基礎(chǔ)有機(jī)化學(xué)】(15分)
-
19.化合物M(
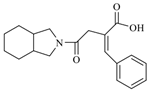 )可以單獨(dú)用于經(jīng)飲食和運(yùn)動(dòng)療法不能有效控制高血糖的Ⅱ型糖尿病病人,其合成路線如圖:
)可以單獨(dú)用于經(jīng)飲食和運(yùn)動(dòng)療法不能有效控制高血糖的Ⅱ型糖尿病病人,其合成路線如圖: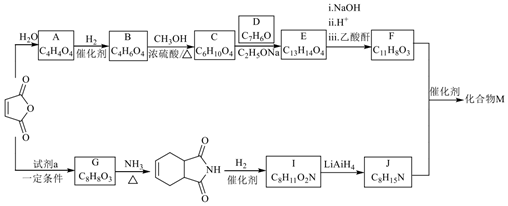
已知:
ⅰ.
ⅱ.
ⅲ.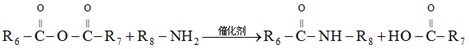
(1)物質(zhì)A中官能團(tuán)的名稱為,物質(zhì)D的名稱為。
(2)I→J的反應(yīng)類型為。
(3)試劑a是1,3-丁二烯,則G的結(jié)構(gòu)簡(jiǎn)式為。
(4)B→C的化學(xué)方程式是。
(5)F的結(jié)構(gòu)簡(jiǎn)式是;F+J→化合物M的過(guò)程中,會(huì)生成N,N與M含有相同的官能團(tuán),且互為同分異構(gòu)體,N的結(jié)構(gòu)簡(jiǎn)式是。
(6)芳香化合物K與B含有相同的官能團(tuán)且官能團(tuán)個(gè)數(shù)相同,其分子式為C10H10O4,苯環(huán)上含有2個(gè)取代基,K可能的結(jié)構(gòu)有種(不考慮立體異構(gòu))。核磁共振氫譜峰面積之比為3:2:2:2:1,其結(jié)構(gòu)簡(jiǎn)式為。組卷:0引用:1難度:0.3


