2022-2023學(xué)年黑龍江省鶴崗一中高二(上)期中化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題(共17小題,每小題3分,共51分。在每小題給出的四個(gè)選項(xiàng)中,只有一項(xiàng)是符合題目要求的。)
-
1.已知下列反應(yīng)的平衡常數(shù):①S(s)+O2(g)?SO2(g)K1;②H2(g)+S(s)?H2S(g)K2;則反應(yīng)H2(g)+SO2(g)?O2(g )+H2S(g)的平衡常數(shù)是( )
A.K1-K2 B.K1+K2 C. K2K1D. K1K2組卷:175引用:3難度:0.8 -
2.下表是25℃時(shí),幾種常見(jiàn)弱酸的電離平衡常數(shù):
下列說(shuō)法正確的是( )酸 CH3COOH HF HCN 電離平衡常數(shù)(Ka) 1.8×10-5 7.2×10-4 5.0×10-10 A.三種酸中酸性最強(qiáng)的是CH3COOH B.三種酸中HF能腐蝕玻璃是因?yàn)槠潆婋x平衡常數(shù)最大 C.若向稀醋酸溶液中滴入一滴冰醋酸,醋酸的電離程度增大 D.在溶液中反應(yīng)HCN+CH3COONa=NaCN+CH3COOH不易發(fā)生 組卷:25引用:5難度:0.6 -
3.在容積不變的密閉容器中進(jìn)行反應(yīng):2SO2(g)+O2(g)?2SO3(g)△H<0.下列各圖表示當(dāng)其他條件不變時(shí),改變某一條件對(duì)上述反應(yīng)的影響,其中分析正確的是( )
A. 
圖表示溫度對(duì)平衡的影響,且甲溫度較高B. 
圖表示t0時(shí)刻恒容充入He(g)C. 
圖表示t0時(shí)刻增大O2的濃度對(duì)反應(yīng)速率的影響D. 
圖中a點(diǎn)v正>v逆組卷:116引用:4難度:0.6 -
4.能夠使CH3COONa溶液pH增大且水解程度也增大的條件是( )
A.加水 B.升溫 C.加壓 D.加CH3COONa固體 組卷:505引用:9難度:0.7 -
5.下列說(shuō)法正確的是( )
A.恒溫恒壓下,ΔH<0且ΔS>0的反應(yīng)一定不能自發(fā)進(jìn)行 B.非自發(fā)的反應(yīng)一定可以通過(guò)改變條件使其成為自發(fā)反應(yīng) C.相同物質(zhì)的量的同種物質(zhì)氣態(tài)時(shí)熵值最小,固態(tài)時(shí)熵值最大 D.反應(yīng)NH3(g)+HCl(g)=NH4Cl(s)在室溫下可自發(fā)進(jìn)行,則該反應(yīng)的ΔH<0 組卷:42引用:14難度:0.8 -
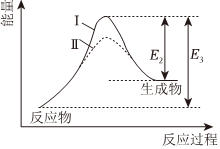 6.已知可逆反應(yīng):A(g)+B(g)=C(g)+D(g)ΔH,在某密閉體系中進(jìn)行該反應(yīng),反應(yīng)過(guò)程中能量變化如圖所示。下列說(shuō)法正確的是( )
6.已知可逆反應(yīng):A(g)+B(g)=C(g)+D(g)ΔH,在某密閉體系中進(jìn)行該反應(yīng),反應(yīng)過(guò)程中能量變化如圖所示。下列說(shuō)法正確的是( )A.E1為逆反應(yīng)的活化能,E2為正反應(yīng)的活化能 B.曲線Ⅱ使用了催化劑,降低了反應(yīng)的焓變 C.ΔH=E1-E2,該反應(yīng)為吸熱反應(yīng) D.活化能越大,反應(yīng)越容易進(jìn)行 組卷:23引用:4難度:0.5 -
7.已知次磷酸(H3PO2)是一元中強(qiáng)酸,下列說(shuō)法不正確的是( )
A.H3PO2中磷元素的化合價(jià)為+1價(jià) B.NaH2PO2的水溶液呈弱酸性 C.H3PO2在水中的電離形式只有:H3PO2?H++H2PO2- D.NaH2PO2屬于正鹽 組卷:122引用:6難度:0.7
二、非選擇題:本題共4小題,共49分。
-
20.(1)在容積為1.00L的容器中,通入一定量的N2O4,發(fā)生反應(yīng)N2O4(g)?2NO2(g),隨溫度升高,混合氣體的顏色變深。
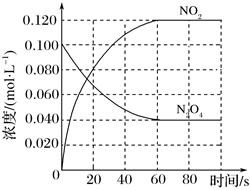
①該反應(yīng)ΔH0(填“>”、“<”或“=”),在0~60s時(shí)段,反應(yīng)速率v(N2O4)為mol?L-1?s-1。平衡常數(shù)K=(請(qǐng)書寫單位)。
②在溫度不變的情況下向平衡體系中再充入N2O40.01mol?L-1和NO20.03mol?L-1此時(shí)v(正)v(逆)(填“>”、“<”或“=”)。
③下列有利于提高反應(yīng)N2O4(g)?2NO2(g)平衡轉(zhuǎn)化率的條件是(填標(biāo)號(hào))。
A.高溫低壓
B.低溫高壓
C.高溫高壓
D.低溫低壓組卷:10引用:1難度:0.7 -
21.(1)選用以下主要儀器和試劑,是否可以達(dá)到測(cè)定NaOH溶液濃度的目的?
(填“是”或“否”)。
主要儀器:滴定管、錐形瓶、燒杯
試劑:NaOH溶液、0.1000mol?L-1鹽酸
(2)現(xiàn)用物質(zhì)的量濃度為0.2000mol?L-1的標(biāo)準(zhǔn)NaOH溶液去滴定20mL鹽酸的物質(zhì)的量濃度,請(qǐng)?zhí)顚懴铝锌瞻祝?br />①用標(biāo)準(zhǔn)NaOH溶液滴定時(shí),應(yīng)將標(biāo)準(zhǔn)NaOH溶液注入(填“甲”或“乙”)中。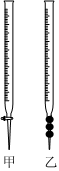
②某學(xué)生的操作步驟如下:
A.移取20.00mL待測(cè)鹽酸溶液注入潔凈的錐形瓶,并加入2~3滴酚酞;
B.用標(biāo)準(zhǔn)溶液潤(rùn)洗滴定管2~3次;
C.把盛有標(biāo)準(zhǔn)溶液的堿式滴定管固定好,調(diào)節(jié)滴定管使尖嘴部分充滿溶液;
D.取標(biāo)準(zhǔn)NaOH溶液注入堿式滴定管至“0”刻度以上2~3mL;
E.調(diào)節(jié)液面至“0”或“0”以下刻度,記下讀數(shù);
F.把錐形瓶放在滴定管的下面,用標(biāo)準(zhǔn)NaOH溶液滴定至終點(diǎn)并記下滴定管液面的刻度。
正確操作步驟的順序是(用字母序號(hào)填寫)。
③上述B步驟操作的目的是。
④判斷到達(dá)滴定終點(diǎn)的實(shí)驗(yàn)現(xiàn)象是。
⑤如圖表示50mL滴定管中液面的位置,如果液面處的讀數(shù)是a,則滴定管中液體體積為(填代號(hào))。
A.a(chǎn)mL
B.大于amL
C.等于(50-a)mL
D.大于(50-a)mL
(3)某研究性學(xué)習(xí)小組用0.2000mol?L-1NaOH標(biāo)準(zhǔn)溶液滴定20.00mL醋酸溶液的濃度,實(shí)驗(yàn)數(shù)據(jù)記錄如下:
計(jì)算醋酸溶液的濃度實(shí)驗(yàn)序號(hào) 1 2 3 4 消耗NaOH溶液的體積 20.07 20.02 18.80 19.97 (保留四位有效數(shù)字)。
(4)濃度影響弱酸、弱堿的電離程度。用pH計(jì)測(cè)定時(shí)不同濃度的醋酸的pH,結(jié)果如表:
①根據(jù)表中數(shù)據(jù),可以得出醋酸是弱電解質(zhì)的結(jié)論,你認(rèn)為得出此結(jié)論的依據(jù)是醋酸濃度 0.0010 0.0100 0.0200 0.1000 0.2000 pH 3.88 3.38 3.23 2.88 2.73 。
②從表中的數(shù)據(jù),還可以得出另一結(jié)論:隨著醋酸濃度的增大,醋酸的電離程度將(填“增大”“減小”或“不變”)。
(5)多元弱酸分步電離,以第一步電離為主,即電離常數(shù)Ka1>Ka2。向0.10mol?L-1二元弱酸H2A溶液逐滴滴入NaOH溶液,溶液中的H2A、HA-、A2-的物質(zhì)的量分?jǐn)?shù)δ(X)隨pH的變化如圖所示[已知δ(X)=]。則Ka1:Ka2=c(X)c(H2A)+c(HA-)+c(A2-)。 組卷:20引用:1難度:0.5
組卷:20引用:1難度:0.5


