2021-2022學年青海省西寧市北外附屬新華聯國際學校高二(上)第一次月考化學試卷(理科)
發布:2024/11/29 19:30:2
一、選擇題(本題共計20小題,每題2分,共計40分)
-
1.若某原子的摩爾質量是16g?mol-1,則2mol該原子的質量為( )
A.16g B.32g C.48g D.64g 組卷:5引用:3難度:0.9 -
2.精確配制一定物質的量濃度的NaOH溶液,下面實驗操作中正確的是( )
A.稱量時,將NaOH固體直接放在天平托盤上面稱量 B.將稱好的NaOH固體放入容量瓶中,加入少量水溶解 C.在燒杯中溶解NaOH固體后,立即將溶液注入容量瓶中 D.將燒杯中已冷卻的NaOH溶液用玻璃棒引流轉移到容量瓶中 組卷:0引用:1難度:0.6 -
3.在反應2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O中,HCl( )
A.全部被氧化 B.全部被還原 C.既表現氧化性又表現酸性 D.既表現還原性又表現酸性 組卷:9引用:3難度:0.5 -
4.在一密閉容器中充入一定量的N2和H2,經測定反應開始后的2s內氮氣的平均速率:v(N2)=0.15mol/(L?s),則2s末NH3的濃度為( )
A.0.60mol/L B.0.50mol/L C.0.45mol/L D.0.55mol/L 組卷:2引用:1難度:0.7 -
5.相同條件下,分別測得反應A(g)+3B(g)?2C(g)+2D(g)的速率如下:
①v(A)=0.15mol?L-1?s-1
②v(B)=0.6mol?L-1?s-1
③v(C)=0.5mol?L-1?s-1
④v(D)=1.2mol?L-1?min-1
其中反應最快的是( )A.① B.② C.③ D.④ 組卷:69引用:4難度:0.5 -
6.下列變化過程,屬于放熱反應的是( )
①液態水變成水蒸氣
②酸堿中和反應
③濃H2SO4稀釋
④固體NaOH溶于水
⑤H2在Cl2中燃燒A.②③④⑤ B.②③④ C.②⑤ D.①③⑤ 組卷:1引用:1難度:0.7 -
7.已知299K時,合成氨反應 N2(g)+3H2(g)?2NH3(g)△H=-92.0kJ/mol,將此溫度下的1mol N2和3mol H2放在一密閉容器中,在催化劑存在時進行反應,測得反應放出的熱量為(忽略能量損失)( )
A.一定大于92.0kJ B.一定等于92.0kJ C.一定小于92.0kJ D.不能確定 組卷:275引用:52難度:0.7 -
8.已知常溫時紅磷比白磷穩定,在下列反應中:P4(白磷,s)+5O2(g)═2P2O5(s)ΔH=akJ/mol;4P(紅磷,s)+5O2(g)═2P2O5(s)ΔH=bkJ/mol。若a、b均小于零,則a和b的關系為( )
A.a<b B.a>b C.a=b D.無法確定 組卷:3引用:2難度:0.4
二、解答題(共4小題,滿分50分)
-
24.(1)隨著化石能源的減少,新能源的開發利用日益迫切.
Bunsen熱化學循環制氫工藝由下列三個反應組成:SO2(g)+I2(g)+2H2O(g)═2HI(g)+H2SO4(l)ΔH=akJ?mol-1,2H2SO4(1)═2H2O(g)+2SO2(g)+O2(g)ΔH=bkJ?mol-1,2HI(g)═H2(g)+I2(g)ΔH=ckJ?mol-1,則:2H2O(g)═2H2(g)+O2(g)ΔH=.
(2)據粗略統計,我國沒有經過處理便排放的焦爐煤氣已超過250億立方米,這不僅是能源的浪費也對環境造成極大污染.為解決這一問題,我國在2004年起已利用焦爐煤氣制取甲醇及二甲醚.已知CO中的C與O之間為三鍵連接,且合成甲醇的主要反應原理為CO(g)+2H2(g)?CH3OH(g).
下表所列為常見化學鍵的鍵能數據:
則該反應的ΔH=化學鍵 C-C C-H H-H C-O C≡O H-O 鍵能(kJ?mol-1) 348 414 436 326.8 1032 464 kJ?mol-1.
(3)已知:2H2(g)+O2(g)═2H2O(1)ΔH=-571.6KJ?mol-1CH4(g)+2O2(g)═CO2(g)+2H2O(1)ΔH=-890kJ?mol-1,現有H2與CH4的混合氣體112L(標準狀況),使其完全燃燒生成CO2和H2O(l),若實驗測得反應放熱3695kJ,則原混合氣體中H2與CH4的物質的量之比是.
(4)恒溫恒容條件下,硫可以發生如圖轉化,其反應過程和能量關系如圖所示.已知:2SO2(g)+O2(g)═2SO3(g)ΔH=-196.6kJ?mol-1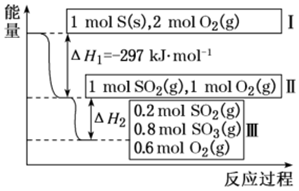
①寫出能表示硫的燃燒熱的熱化學方程式:.
②ΔH2=kJ?mol-1.組卷:35引用:1難度:0.4
六、(10分)計算題
-
25.把0.6mol X氣體和0.6mol Y氣體混合于2L密閉容器中,使它們發生如下反應:2X(g)+Y(g)=nZ(g)+2W(g).2min 末已生成0.2mol W,若測知以Z的濃度變化表示的反應速率為0.1mol?L-1?min-1,計算:
(1)前2min內用X的濃度變化表示的平均反應速率.
(2)2min末時Y的濃度.
(3)化學反應方程式中n的值是多少?組卷:22引用:6難度:0.5


