2021-2022學年遼寧省丹東市高二(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題:本題共15小題,每小題3分,共45分.在每小題給出的四個選項中,只有一項是符合題目的要求.
-
1.下列裝置工作時,將電能轉化為化學能的是( )


A.和諧號動車以350km/h飛馳 B.硅太陽能電池 C.紐扣式銀鋅電池 D.電解熔融氯化鈉 A.A B.B C.C D.D 組卷:4引用:3難度:0.7 -
2.下列說法不正確的是( )
A.基態碳原子的核外電子軌道表示式: 
B.基態原子的核外電子填充在6個軌道中的元素有兩種 C.基態銅原子簡化電子排布式表示為[Ar]3d94s2違背了泡利原理 D.基態鉀離子(K+)電子占據的最高能級共有3個原子軌道,其形狀是啞鈴形 組卷:55引用:2難度:0.8 -
3.下列離子方程式書寫不正確的是( )
A.制取Fe(OH)3膠體:Fe3++3H2O Fe(OH)3(膠體)+3H+△B.用TiCl4制備TiO2的反應:TiCl4+(x+2)H2O═TiO2?xH2O↓+4HCl C.泡沫滅火器原理:AlO2-+HCO3-+H2O═Al(OH)3↓+CO32- D.H2S的第一步電離方程式:H2S+H2O?H3O++HS- 組卷:4引用:1難度:0.7 -
4.現有短周期主族元素X、Y、Z、R和T,原子序數依次增大。X的電子只有一種自旋取向,Y原子價電子數是能層數的2倍,R、T均為s能級與p能級電子總數相等的原子。下列推斷正確的是( )
A.離子半徑:T>R>Z B.電負性:Y>Z>R C.第一電離能:R>Z>Y D.X和R形成的化合物可能含非極性鍵 組卷:14引用:1難度:0.5 -
5.下列實驗現象和結論均正確的是( )
選項 實驗操作 實驗現象及結論 A 取A、B兩支試管,各加入4mL0.5mol/L的酸性高錳酸鉀溶液,然后向A試管中加入2mL0.1mol/LH2C2O4(草酸)溶液,同時向B試管中加入2mL0.2mol/LH2C2O4溶液 B試管中的高錳酸鉀溶液褪色快.說明其他條件不變時,反應物的濃度越大,反應速率越快 B 取A、B兩支試管,各加入2mL0.1mol/L的Na2S2O3溶液和2mL0.1mol/L的稀硫酸,并將A試管放置于熱水中,B試管放置于冷水中 A試管中先析出沉淀.說明當其他條件不變時,升高溫度,活化分子百分數增多,反應速率加快 C 在恒溫恒壓的密閉容器中發生反應:2NH3(g)?N2(g)+3H2(g),向其中通入氬氣 容器體積增大,反應速率減慢.說明增大容器體積,壓強減小,活化分子百分數減少,反應速率減慢 D A、B兩支試管中分別加入等體積5%的H2O2溶液,在B試管中加入2~3滴FeCl3溶液 B試管中產生氣泡快.說明當其他條件不變時,使用催化劑,增大反應活化能,反應速率加快 A.A B.B C.C D.D 組卷:11引用:1難度:0.5 -
 6.一種新型的鋰一空氣電池的工作原理如圖所示,關于該電池的說法正確的是( )
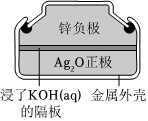
6.一種新型的鋰一空氣電池的工作原理如圖所示,關于該電池的說法正確的是( )A.電子由金屬鋰流出經過電解液流入多孔碳 B.可將有機電解液改為水溶液 C.金屬鋰作正極,發生氧化反應 D.電池總反應為4Li+O2+2H2O═4LiOH 組卷:50引用:1難度:0.6 -
7.下列說法正確的是( )
A.CH4、CCl4都是含有極性鍵的極性分子 B.CH3-與NH3、H3O+的空間結構均為三角錐形 C.CS2、H2O、C2H2都是直線形分子 D.分子中共價鍵的鍵能越大,分子的熔、沸點越高 組卷:33引用:1難度:0.7
二、非選擇題:本題共6小題,共55分.
-
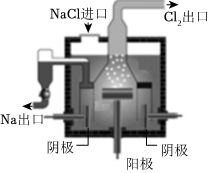
 20.化學在環境保護中起著十分重要的作用,電化學降解法可用于治理水中硝酸鹽的污染.電化學降解的原理如圖所示.據圖回答:NO-3
20.化學在環境保護中起著十分重要的作用,電化學降解法可用于治理水中硝酸鹽的污染.電化學降解的原理如圖所示.據圖回答:NO-3
(1)電源正極為(填A或B),陰極的電極反應式為.
(2)若電解過程中轉移了5mol電子,則膜兩側電解液的質量變化差(△m左-△m右)為g.組卷:35引用:2難度:0.3 -
21.用NaOH標準液滴定未知濃度的H2A溶液,其操作步驟如下:
①用蒸餾水洗滌堿式滴定管,并立即注入NaOH溶液至“0”刻度線以上;
②固定好滴定管并使滴定管尖嘴處充滿溶液;
③調節液面至“0”或“0”刻度線以下,并記下讀數;
④移取20.00mL待測液注入潔凈的未干燥的錐形瓶中,加入2滴指示劑溶液;
⑤用標準液滴定至終點,記下滴定管液面讀數.
請回答下列問題:
(1)以上操作步驟有錯誤的是(填數字序號).下列操作中,能造成中和滴定的測定結果偏高的有(填字母序號).
a.配制標準溶液的固體NaOH中混有KOH雜質
b.中和滴定到達終點時俯視滴定管內液面讀數
c.振蕩時錐形瓶中溶液飛濺出來
d.滴定到終點讀數時,發現滴定管尖嘴處懸掛一滴溶液
(2)某同學在滴定實驗中,堿式滴定管中的液面如圖1所示.側消耗的NaOH溶液的體積為mL.
(3)常溫下向0.2000mol/L二元酸H2A溶液中滴加0.2000mol/LNaOH溶液.溶液中H2A、HA-、A2-的物質的量分數(δ)隨溶液pH的變化關系如圖2所示.
①下列說法正確的是(填字母序號).
A.該滴定過程若選擇單一指示劑最好選擇甲基橙
B.當V(NaOH溶液)=V(H2A)時,溶液中存在:c(H+)+c(H2A)=c(A2-)+c(OH-)
C.pH=6.27時,c(A2-)+c(HA-)>c(H+)>c(OH-)
D.V(NaOH溶液):V(H2A)=3:2時,3c(Na+)=2c(H2A)+2c(HA-)+2c(A2-)
②常溫下H2A的電離平衡常數Kal=.
③當pH=6時2c(A2-)+c(HA-)-c(Na+)=mol/L.
④滴加至a、b、c三個交點處,溶液中水的電離程度由大到小依次為(用字母排序).組卷:44引用:1難度:0.6


