人教版(2019)選擇性必修1《2.2 化學(xué)平衡》2020年同步練習(xí)卷(11)
發(fā)布:2024/4/20 14:35:0
-
1.壓強(qiáng)變化不會(huì)使下列化學(xué)反應(yīng)的平衡發(fā)生移動(dòng)的是( )
A.H2(g)+I2(g)?2 HI(g) B.3H2(g)+N2(g)?2NH3(g) C.2SO2(g)+O2(g)?2SO3(g) D.C(s)+CO2(g)?2CO(g) 組卷:60引用:8難度:0.9 -
2.已知?dú)庀嘀苯铀戏ㄖ迫∫掖嫉姆磻?yīng)為H2O(g)+C2H4(g)?CH3CH2OH(g)。在容積為3L的密閉容器中,當(dāng)n(H2O):n(C2H4)=1:1時(shí),乙烯的平衡轉(zhuǎn)化率與溫度、壓強(qiáng)的關(guān)系如圖所示。下列說(shuō)法正確的是( )

A.a(chǎn)、b兩點(diǎn)平衡常數(shù):b>a B.壓強(qiáng)大小順序:P1>P2>P3 C.當(dāng)混合氣的密度不變時(shí)反應(yīng)達(dá)到了平衡 D.其他條件不變,增大起始投料 ,可提高乙烯轉(zhuǎn)化率n(H2O)n(C2H4)組卷:447引用:9難度:0.7 -
3.將NO2裝入帶活塞的密閉容器中,當(dāng)反應(yīng)2NO2(g)?N2O4(g)達(dá)到平衡后,改變下列一個(gè)條件,其中敘述正確的是( )
A.升高溫度,氣體顏色加深,則此反應(yīng)為吸熱反應(yīng) B.慢慢壓縮氣體體積,平衡向右移動(dòng),混合氣體顏色變淺 C.慢慢壓縮氣體體積,若體積減小一半,壓強(qiáng)增大,但小于原來(lái)的兩倍 D.恒溫恒容時(shí),充入少量惰性氣體,壓強(qiáng)增大,平衡向右移動(dòng),混合氣體的顏色變淺 組卷:134引用:20難度:0.7 -
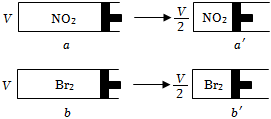 4.兩個(gè)體積相同帶活塞的容器,分別盛裝一定量的NO2和Br2(g),都為一樣的紅棕色,迅速將兩容器同時(shí)壓縮到原來(lái)的一半(如圖)假設(shè)氣體不液化,則下列說(shuō)法正確的是( )
4.兩個(gè)體積相同帶活塞的容器,分別盛裝一定量的NO2和Br2(g),都為一樣的紅棕色,迅速將兩容器同時(shí)壓縮到原來(lái)的一半(如圖)假設(shè)氣體不液化,則下列說(shuō)法正確的是( )A.a(chǎn)→a′過(guò)程中,顏色突然加深,然后逐漸變淺,最終顏色比原來(lái)的淺 B.a(chǎn)′,b′的顏色一樣深 C.a(chǎn)′的壓強(qiáng)比a的壓強(qiáng)2倍要小,b′的壓強(qiáng)為b的壓強(qiáng)的2倍 D.a(chǎn)′中的c(NO2)一定比b′中的c(Br2 )小 組卷:77引用:8難度:0.7 -
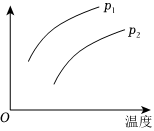 5.在容積一定的密閉容器中發(fā)生可逆反應(yīng):A(g)+2B(g)?2C(g);ΔH>0(表示吸熱).平衡移動(dòng)關(guān)系如圖所示,下列說(shuō)法正確的是( )
5.在容積一定的密閉容器中發(fā)生可逆反應(yīng):A(g)+2B(g)?2C(g);ΔH>0(表示吸熱).平衡移動(dòng)關(guān)系如圖所示,下列說(shuō)法正確的是( )A.P1>P2,縱坐標(biāo)指C的質(zhì)量分?jǐn)?shù) B.P1<P2,縱坐標(biāo)指A的質(zhì)量分?jǐn)?shù) C.P1<P2.縱坐標(biāo)指A的轉(zhuǎn)化率 D.P1<P2,縱坐標(biāo)指混合氣體的平均摩爾質(zhì)量 組卷:76引用:7難度:0.7 -
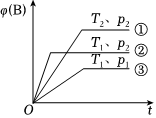 6.已知某可逆反應(yīng)mA(g)+nB(g)?pC(g)在密閉容器中進(jìn)行,如圖表示在不同反應(yīng)時(shí)間t時(shí),溫度T和壓強(qiáng)p與反應(yīng)物B在混合氣體中的體積分?jǐn)?shù)[φ(B)]的關(guān)系曲線,由曲線分析,下列判斷正確的是( )
6.已知某可逆反應(yīng)mA(g)+nB(g)?pC(g)在密閉容器中進(jìn)行,如圖表示在不同反應(yīng)時(shí)間t時(shí),溫度T和壓強(qiáng)p與反應(yīng)物B在混合氣體中的體積分?jǐn)?shù)[φ(B)]的關(guān)系曲線,由曲線分析,下列判斷正確的是( )A.T1<T2,p1>p2,m+n>p,放熱反應(yīng) B.T1>T2,p1<p2,m+n>p,吸熱反應(yīng) C.T1<T2,p1>p2,m+n<p,放熱反應(yīng) D.T1>T2,p1<p2,m+n<p,吸熱反應(yīng) 組卷:277引用:25難度:0.7 -
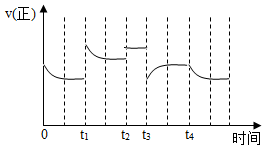 7.合成氨反應(yīng):N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1,在反應(yīng)過(guò)程中,正反應(yīng)速率的變化如圖。下列說(shuō)法正確的是( )
7.合成氨反應(yīng):N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1,在反應(yīng)過(guò)程中,正反應(yīng)速率的變化如圖。下列說(shuō)法正確的是( )A.t1時(shí)升高了溫度 B.t2時(shí)使用了催化劑 C.t3時(shí)增大了壓強(qiáng) D.t4時(shí)降低了溫度 組卷:281引用:48難度:0.7 -
8.對(duì)于反應(yīng)2A(g)+B(g)?2C(g)(正反應(yīng)放熱),下列圖象正確的是( )
A. 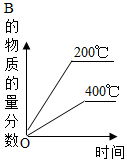
B. 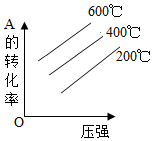
C. 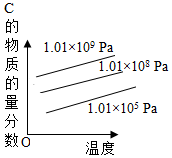
D. 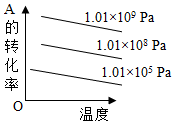 組卷:50引用:2難度:0.6
組卷:50引用:2難度:0.6
-
 24.氮的固定一直是科學(xué)家研究的重要課題,合成氨則是人工固氮比較成熟的技術(shù),其原理為N2(g)+3H2(g)?2NH3(g)
24.氮的固定一直是科學(xué)家研究的重要課題,合成氨則是人工固氮比較成熟的技術(shù),其原理為N2(g)+3H2(g)?2NH3(g)
在不同溫度、壓強(qiáng)和相同催化劑條件下,初始時(shí)N2、H2分別為0.1mol、0.3mol時(shí),平衡后混合物中氨的體積分?jǐn)?shù)(φ)如圖所示。
①其中,p1、p2和p3由大到小的順序是,其原因是。
②若分別用vA(N2)和vB(N2)表示從反應(yīng)開(kāi)始至達(dá)平衡狀態(tài)A、B時(shí)的化學(xué)反應(yīng)速率,則vA(N2)vB(N2)(填“>”、“<”或“=”)。
③若在250℃、p1為105Pa條件下,反應(yīng)達(dá)到平衡時(shí)容器的體積為1L,則該條件下B點(diǎn)N2的分壓p(N2)為Pa.(分壓=總壓×物質(zhì)的量分?jǐn)?shù),保留一位小數(shù))組卷:17引用:3難度:0.4 -
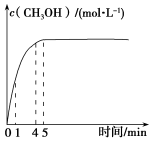 25.甲醇是重要的化工原料,利用煤化工中生產(chǎn)的CO和H2可制取甲醇,發(fā)生的反應(yīng)為CO(g)+2H2(g)?CH3OH(g)△H=-99kJ?mol-1.
25.甲醇是重要的化工原料,利用煤化工中生產(chǎn)的CO和H2可制取甲醇,發(fā)生的反應(yīng)為CO(g)+2H2(g)?CH3OH(g)△H=-99kJ?mol-1.
(1)關(guān)于該反應(yīng)的下列說(shuō)法中,錯(cuò)誤的是.
A.消耗CO和消耗CH3OH的速率相等時(shí),說(shuō)明該反應(yīng)達(dá)到平衡狀態(tài)
B.升高溫度,正反應(yīng)速率減小,逆反應(yīng)速率增大
C.使用催化劑,可以提高CO的轉(zhuǎn)化率
D.增大壓強(qiáng),該反應(yīng)的化學(xué)平衡常數(shù)不變
(2)在某溫度時(shí),將1.0mol CO與2.0mol H2充入2L的空鋼瓶中,發(fā)生上述反應(yīng),在第5min時(shí)達(dá)到化學(xué)平衡狀態(tài),此時(shí)甲醇的物質(zhì)的量分?jǐn)?shù)為10%.甲醇濃度的變化狀況如圖所示。
①?gòu)姆磻?yīng)開(kāi)始到5min時(shí),生成甲醇的平均速率為.
②1min時(shí)的v正(CH3OH)4min時(shí)v逆(CH3OH)(填“大于”、“小于”或“等于”).
③若將鋼瓶換成同容積的絕熱鋼瓶,重復(fù)上述實(shí)驗(yàn),平衡時(shí)甲醇的物質(zhì)的量分?jǐn)?shù)0.1。(填“>”、“<”或“=”)組卷:6引用:1難度:0.5


