2020-2021學年福建省廈門一中高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、單選題(本題共10小題,1-10每小題2分,每小題只有一個選項符合題意,共20分)
-
1.下列化學用語正確的是( )
A.電解液為稀硫酸的甲醇燃料電池中,負極的電極反應式為:CH3OH-6e-+H2O═CO2+6H+ B.鉛蓄電池充電時陽極電極反應式為:Pb-2e-+ ═PbSO4SO2-4C.用惰性電極電解熔融氯化鈉:2Cl-+2H2O Cl2↑+H2↑+2OH-通電D.CH4燃燒熱的熱化學方程式為:CH4(g)+2O2(g)═CO2(g)+2H2O(g)ΔH=-890kJ/mol 組卷:68引用:3難度:0.6 -
2.已知1g氫氣完全燃燒生成水蒸氣時放出熱量121kJ,且氧氣中1molO=O鍵完全斷裂時吸收熱量496kJ,水蒸氣中1mol H-O鍵形成時放出熱量463kJ,則氫氣中1molH-H鍵斷裂時吸收熱量為( )
A.920kJ B.557kJ C.436kJ D.188kJ 組卷:749引用:125難度:0.7 -
3.對可逆反應2A(s)+3B(g)=C(g)+2D(g)△H<0。一定條件下達到平衡,下列說法正確的是( )
A.增加A的量,平衡向正反應方向移動 B.升高溫度,平衡向逆反應方向移動,v正減小 C.增大B的濃度,v正>v逆 D.壓強增大一倍,平衡不移動,v正、v逆不變 組卷:5引用:1難度:0.6 -
4.合成氨時,既要使原料的轉化率增大,同時又要使反應速率加快,可采取什么措施( )
①減壓
②加壓
③升溫
④降溫
⑤及時從平衡混合氣中分離出NH3
⑥補充N2或H2
⑦加催化劑
⑧減小N2或H2的量A.③④⑤⑦ B.②⑤⑥ C.②⑥ D.②③⑥⑦ 組卷:6引用:1難度:0.7 -
5.在2L密閉容器中,發生3Xg+Yg=2Zg的反應,若最初加入的X和Y都是4mol,X的平均速率為0.12mol/L?s則10s后容器中的Y是( )
A.1.6mol B.2.8mol C.3.6mol D.3.2mol 組卷:9引用:1難度:0.7 -
6.體積相同的甲、乙兩個容器中,分別都充入等物質的量的A2和B2,在相同溫度下發生反應:2A2(g)+B2(g)=2C(g)并達到平衡,反應過程中,甲容器保持體積不變,乙容器保持壓強不變,甲容器中A2的轉化率為P%,則乙容器中的A2轉化率為( )
A.大于P% B.等于P% C.小于P% D.無法判斷 組卷:5引用:1難度:0.7
三、解答題(共5小題,滿分46分)
-
19.某同學在用稀硫酸與鋅制取氫氣的實驗中,發現加入少量硫酸銅溶液可加快氫氣的生成速率.請回答下列問題:
(1)上述實驗中發生反應的化學方程式有、.
(2)加入硫酸銅溶液后可以加快氫氣生成速率的原因是.
(3)實驗室中現有Na2SO4、MgSO4、Ag2SO4、K2SO4等4種溶液,可與上述實驗中CuSO4溶液起相似作用的是.
(4)要加快上述實驗中氫氣生成速率,還可采取的措施有;(答兩種即可).
(5)為了進一步研究硫酸銅的量對氫氣生成速率的影響,該同學設計了如表一系列的實驗:將表中所給的混合溶液分別加入到6個盛有過量Zn粒的容器中,收集產生的氣體,記錄獲得相同體積的氣體所需時間.
①請完成此實驗設計,其中:V1=
實驗
混合溶液A B C D E F 4mol/L H2SO4(mL) 30 V1 V2 V3 V4 V5 飽和CuSO4溶液(mL) 0 0.5 2.5 5 V6 20 H2O(mL) V7 V8 V9 V10 10 0 ,V6=.
②該同學最后得出的結論為:當加入少量CuSO4溶液時,生成氫氣的速率會大大提高,但當加入的CuSO4溶液超過一定量時,生成氫氣的速率反而會下降.請分析氫氣生成速率下降的主要原因.組卷:18引用:2難度:0.1 -
20.碳的化合物在工業上應用廣泛,下面有幾種碳的化合物的具體應用:
(1)已知下列熱化學方程式:
ⅰ.CH2=CHCH3(g)+Cl2(g)═CH2ClCHClCH3(g)△H1=-133kJ?mol-1
ⅱ.CH2=CHCH3(g)+Cl2(g)═CH2=CHCH2Cl(g)+HCl(g)△H2=-100kJ?mol-1
又已知在相同條件下,CH2=CHCH2Cl(g)+HCl(g)═CH2ClCHClCH3(g)的正反應的活化能Ea(正)為132kJ?mol-1,則逆反應的活化能Ea(逆)為kJ?mol-1。
(2)查閱資料得知,反應CH3CHO(aq)═CH4(g)+CO(g)在含有少量I2的溶液中分兩步進行:第Ⅰ步反應為CH3CHO(aq)+I2(aq)→CH3I(l)+HI(aq)+CO(g)(慢反應),第Ⅱ步為快反應。增大I2的濃度(填“能”或“不能”)明顯增大總反應的平均速率,理由為。
(3)用催化劑Fe3(CO)12/ZSM-5催化CO2加氫合成乙烯的反應,所得產物含CH4、C3H6、C4H8等副產物,反應過程如圖。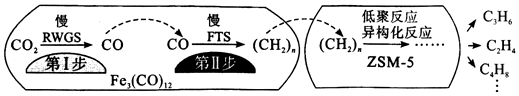
催化劑中添加Na、K、Cu助劑后(助劑也起催化作用)可改變反應的選擇性,在其他條件相同時,添加不同助劑,經過相同時間后測得CO2轉化率和各產物的物質的量分數如表。
欲提高單位時間內乙烯的產量,在Fe3(CO)12/ZSM-5中添加助劑 CO2轉化率(%) 各產物在所有產物中的占比(%) C2H4 C3H6 其他 Na 42.5 35.9 39.6 24.5 K 27.2 75.6 22.8 1.6 Cu 9.8 80.7 12.5 6.8 助劑效果最好;加入助劑能提高單位時間內乙烯產量的根本原因是。
(4)在一密閉容器中,起始時向該容器中充入H2S和CH4且n(H2S):n(CH4)=2:1,發生反應:CH4(g)+2H2S(g)?CS2(g)+4H2(g)。0.11MPa時,溫度變化對平衡時產物的物質的量分數的影響如圖1所示:為提高H2S的平衡轉化率,除改變溫度外,還可采取的措施是(列舉一條)。N點對應溫度下,該反應的Kp=(MPa)2(Kp為以分壓表示的平衡常數)。
(5)合成碳酸二甲酯的工作原理如圖2所示。陽極的電極反應式為,離子交換膜a為(填“陽膜”、“陰膜”)。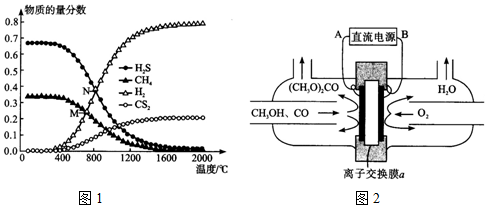 組卷:75引用:8難度:0.7
組卷:75引用:8難度:0.7


