2021-2022學年四川省成都三十七中高一(上)期中化學試卷
發布:2024/4/20 14:35:0
一、本卷共20題,每題2分,共40分。每題給出的四個選項中,只有一項是符合題目要求
-
1.化學,讓生活更美好。下列有關化學知識描述不正確的是( )
A.不同墨水混用時可能使鋼筆流水不暢或者堵塞,這與膠體的聚沉有關 B.食物腐敗、植物光合作用都與氧化還原反應有關 C.鋼鐵生銹、沙里淘金、蒸餾法制取蒸餾水都涉及了化學變化 D.夏日的傍晚常常看到萬丈霞光穿云而過美不勝收與膠體的性質有關 組卷:26引用:3難度:0.8 -
2.下列與化學實驗安全相關的說法中正確的是( )
A.實驗室用CaCO3固體與稀鹽酸制取CO2,多倒出的CaCO3固體不能再放回原試劑瓶 B.H2還原灼熱的氧化銅時,點燃酒精燈前必須先檢驗H2的純度 C.含硫酸銅的廢液倒入水槽,用水沖入下水道 D.少量濃硫酸沾在皮膚上,立即用氫氧化鈉溶液沖洗 組卷:13引用:5難度:0.9 -
3.分類是化學學習與研究的常用方法,下列分類正確的是( )
A.非金屬氧化物均屬于酸性氧化物 B.根據是否具有丁達爾效應,將分散系分為溶液、濁液和膠體 C.根據物質在水溶液中的電離情況,將物質分為電解質和非電解質 D.根據反應過程中是否有能量變化,把化學反應分為放熱反應和吸熱反應 組卷:4引用:1難度:0.6 -
4.下列物質分類完全正確的一組是( )
選項 純凈物 混合物 電解質 非電解質 A 純凈的空氣 鹽酸 硫酸 硫酸鋇 B 膽礬 肥皂水 氧化鋁 干冰 C 純堿 玻璃 鋁 蔗糖 D 生石灰 Fe(OH)3膠體 氯化鈉 氯氣 A.A B.B C.C D.D 組卷:46引用:3難度:0.7 -
5.三個密閉容器中分別充入N2、H2、O2三種氣體,以下各種情況下排序正確的是( )
A.當它們的體積和溫度、壓強均相同時,三種氣體的密度ρ(H2)>ρ(N2)>ρ(O2) B.當它們的溫度和密度都相同時,三種氣體的壓強p(H2)<p(N2)<p(O2) C.當它們的質量和溫度、壓強均相同時,三種氣體的體積V(O2)<V(N2)<V(H2) D.當它們的壓強和體積、溫度均相同時,三種氣體的質量m(H2)>m(N2)>m(O2) 組卷:301引用:4難度:0.6 -
6.碳酸鋰廣泛應用于陶瓷和醫藥等領域。以β-鋰輝石(主要成分為Li2O?AI2O3?4SiO2)為原材料制備Li2CO3的工藝流程如圖所示:
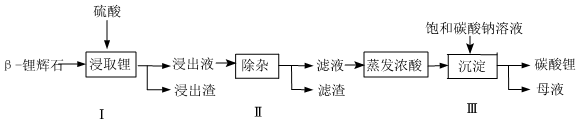
已知:Fe3+、Al3+、Fe2+和Mg2+以氫氧化物形式完全沉淀時,溶液的pH分別為3.2、5.2、9.7和12.4;Li2SO4、LiOH和Li2CO3在303K下的溶解度分別為34.2g、12.7g和1.3g。下列說法不正確的是( )A.步驟Ⅰ前,β-鋰輝石要粉碎成細顆粒的目的是增大與硫酸的接觸面積使反應更加充分 B.步驟Ⅰ中,酸浸后得到的酸性溶液中含有Li+、 ,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等雜質,需在攪拌下加入硫酸以調節溶液的PH到6.0~6.5,沉淀部分雜質離子,然后分離得到浸出液SO2-4C.步驟Ⅱ中,將適量的H2O2溶液、石灰乳和NaCO3溶液依次加入浸出液中,可除去的雜質金屬離子有Fe2+、Mg2+、Ca2+ D.從母液中可回收的主要物質是Na2SO4 組卷:15引用:1難度:0.6 -
7.對于某些離子的檢驗及結論一定正確的是( )
A.向某溶液中加入稀鹽酸產生無色氣體,將氣體通入澄清石灰水中,溶液變渾濁,則原溶液中一定有 CO2-3B.向某溶液中加入氯化鋇溶液有白色沉淀產生,再加稀硝酸,沉淀不消失,則原溶液中一定有Ag+ C.向某溶液中先加入鹽酸酸化,沒有明顯現象,再加入BaCl2溶液,有白色沉淀產生,則原溶液中一定有 SO2-4D.向某溶液中加入碳酸鈉溶液產生白色沉淀,再加鹽酸白色沉淀消失,則原溶液一定有Ba2+ 組卷:122引用:31難度:0.7 -
8.下列離子方程式書寫正確的是( )
A.鐵與H2SO4溶液反應:2Fe+6H+═2Fe3++3H2↑ B.少量小蘇打溶液與澄清石灰水:HCO3-+Ca2++OH-═CaCO3↓+H2O C.碳酸鋇與鹽酸:CO32-+2H+═H2O+CO2↑ D.硫酸溶液與氫氧化鋇溶液反應:H++SO42-+OH-+Ba2+=H2O+BaSO4↓ 組卷:48引用:3難度:0.6
二、解答題(共6小題,滿分60分)
-
25.現有mg某氣體X2,已知在相同條件下,它對氫氣的相對密度為d,則
(1)在一定條件下,決定該氣體的體積的主要因素為。
A、氣體的分子數
B、氣體分子的體積
C、溫度
D、密度
E、壓強
F、氣體分子的質量
(2)mg該氣體X2含有的原子的物質的量為mol。
(3)標況下該氣體的密度為g/mL。
(4)已知反應X2+H2═2HX,若mgX2恰好完全反應,生成的HX通入水中恰好生成1mol/L的HX溶液2L,則X2的相對分子質量為。
(5)標況下,mg氣體X2與一定質量的氣體Y2混合,其總質量為Mg,體積為22.4L,計算Y2的摩爾質量為。組卷:15引用:1難度:0.7 -
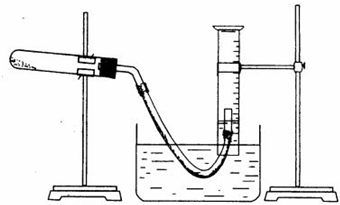 26.某學生利用氯酸鉀分解制氧氣的反應,測定氧氣的摩爾質量。實驗步驟如下:
26.某學生利用氯酸鉀分解制氧氣的反應,測定氧氣的摩爾質量。實驗步驟如下:
①把適量的氯酸鉀粉末和少量二氧化錳粉末混合均勻,放入干燥的試管中,準確稱量,質量為a g。
②裝好實驗裝置。
③檢查裝置氣密性。
④加熱,開始反應,直到產生一定量的氣體。
⑤停止加熱(如圖,導管出口高于液面)。
⑥測量收集到氣體的體積。
⑦準確稱量試管和殘留物的質量為b g。
⑧測量實驗室的溫度。
⑨把殘留物倒入指定的容器中,洗凈儀器,放回原處,把實驗桌面收拾干凈。
⑩處理實驗數據,求出氧氣的摩爾質量。
回答下列問題:
(1)如何檢查裝置的氣密性?。
(2)以下是測量收集到氣體體積必須包括的幾個步驟;①調整量筒內外液面高度使之相同;②使試管和量筒內的氣體都冷卻至室溫;③讀取量筒內氣體的體積。這三步操作的正確順序是:(請填寫步驟代號)
(3)測量收集到氣體體積時,如何使量筒內外液面的高度相同?。
(4)如果實驗中得到的氧氣體積是c L(25℃、1.01×105 Pa),水蒸氣的影響忽略不計,氧氣的摩爾質量的計算式為(含a、b、c,不必化簡):M(O2)=。組卷:622引用:17難度:0.5


