2023年江蘇省鹽城市阜寧縣中考化學二模試卷
發布:2024/4/20 14:35:0
一、選擇題(本大題共13小題,每小題2分,共30分。每小題只有一個選項符合題意,請將正確答案的字母涂在答題卡對應的題號上。)
-
1.母親節到了,小莉想為媽媽做一頓午餐,食譜為:米飯、雞肉、蛋湯、大蝦、魚。為使營養均衡,你覺得最好還要補充( )
A.鴨肉 B.豆漿 C.青菜 D.牛奶 組卷:286引用:53難度:0.9 -
2.2023年4月15日至16日,代表著青春和活力的草莓音樂節走進秀美怡人的阜寧金沙湖畔,給我們帶來了獨特的視聽體驗。參加音樂節的觀眾購買的下列物品中屬于純凈物的是( )
A.氮氣球里面的氮氣 B.驅蚊水 C.爆米花 D.冰紅茶 組卷:33引用:3難度:0.9 -
 3.冬奧會吉祥物“冰墩墩”的外殼主要用環保塑料制作而成。塑料屬于( )
3.冬奧會吉祥物“冰墩墩”的外殼主要用環保塑料制作而成。塑料屬于( )A.金屬材料 B.合成材料 C.復合材料 D.天然材料 組卷:18引用:1難度:0.8 -
4.下列做法不能達到目的的是( )
A.利用活性炭凈水可以將硬水軟化 B.使用無磷洗衣粉能減少水體污染 C.利用灼燒法可以區分棉花和羊毛 D.食用鐵強化醬油可以預防缺鐵性貧血 組卷:19引用:2難度:0.7 -
5.用下列裝置進行實驗,不能達到實驗目的的是( )
A. 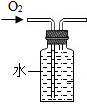
收集O2B. 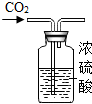
干燥CO2C.  驗證CO2性質
驗證CO2性質D. 
監控氣體流速組卷:279引用:76難度:0.6
二、非選擇題(本大題共40分)
-
18.鹽城瀕臨黃海,海鹽文化全國知名,海洋資源豐富,應用前景廣闊。

(1)海水曬鹽。如圖是利用海水提取粗鹽的過程:
①“蒸發池”中質量逐漸減少的物質是(填化學式)。
②實驗室里除去粗鹽中難溶性雜質一般步驟為溶解、過濾、蒸發,這三種基本操作中都要使用的玻璃儀器是。
③析出晶體后的“母液”中含有MgCl2,向母液中加入澄清石灰水有白色沉淀生成,該復分解反應的化學方程式為。
④在粗鹽的提純實驗中,下列操作正確的有。
A.用裝置甲溶解固體
B.用裝置乙進行過濾
C.用裝置丙蒸發濾液
D.用裝置丁稱量固體
(2)海水利用。
Ⅰ.利用海水提取溴(Br2),其主要反應之一是在一定條件下,將氯氣通入濃縮的海水中,氯氣與海水中的溴化鈉反應得到溴和氯化鈉。該反應說明氯氣和溴的化學活潑性:Br2Cl2(填“>”或“<”)。
Ⅱ.利用氯化鈉制備碳酸鈉的同時可以得到氯化銨,下表為氯化銨的溶解度:
①100g水中不斷加入氯化銨固體或改變溫度,得到下圖相應的溶液A~E。溫度/℃ 0 10 20 30 40 50 60 70 80 溶解度/g 29.4 33.3 37.2 41.4 45.8 50.4 55.2 60.2 65.6 
溶液D是(填“飽和”或“不飽和”)溶液,溶液E中析出晶體g。
②將盛有溶液E的小燒杯放入盛有水的大燒杯中,向大燒杯內加入NaOH固體,小燒杯內的固體溶解,原因是。
(3)海底探物。海底埋藏著大量的“可燃冰”,其主要成分是甲烷水合物(由甲烷分子和水分子組成),還含有少量的CO2等氣體。
①下列說法正確的是(填字母,可多選)。
A.可燃冰和冰成分相同
B.可燃冰與煤相比是較清潔燃料
C.可燃冰和石油都屬于可再生能源
D.可燃冰有可能成為人類未來的重要能源
②利用CH4和H2O進行催化重整制氫氣,反應前后分子變化的微觀示意圖如圖所示。其中“乙→丙”發生反應后,生成的物質質量比是。 組卷:47引用:1難度:0.5
組卷:47引用:1難度:0.5 -
19.硫酸銅在生產、生活中有著廣泛的應用。
(一)硫酸銅的廣泛應用
(1)工業上,硫酸銅可用于濕法煉銅,原理是:(化學方程式表示)。
(2)農業上,硫酸銅可以與混合,配制農藥波爾多液。
(二)硫酸銅晶體的制備
工業上用含銅廢料(如:碎銅、電纜皮等)制備硫酸銅晶體(CuSO4?5H2O)主要流程如下:
(1)含銅廢料粉碎的目的是。
(2)該流程中,加入H2O2后要求溫度控制在50℃到60℃加熱的原因為。
(三)重識硫酸銅
某興趣小組同學將NaOH溶液滴入CuSO4溶液中,觀察到溶液中產生了淺綠色的沉淀。這與教材中描述的現象不一致,于是他對該淺綠色沉淀的成分進行探究。
【提出問題】淺綠色固體的成分是什么?
【查閱資料】
①當溫度達到66℃-68℃時,Cu(OH)2的受熱分解,生成兩種氧化物;
②NaOH與CuSO4反應會生成Cu(OH)2,也會生成Cu4(OH)6SO4(堿式硫酸銅);
③Cu4(OH)6SO4不溶于水,能與酸反應,分解溫度需300℃。
【建立假設】
假設一:淺綠色固體為Cu(OH)2和Cu4(OH)2SO4
假設二:淺綠色固體為Cu(OH)2
假設三:。
(四)拓展與分析步驟 實驗操作 實驗現象 結論 1 取少許淺綠色固體放入試管中,加熱至100℃ 產生黑色固體物質 假設一成立 2 另取少許淺綠色固體放入試管中,加入足量稀硝酸,再滴加硝酸鋇溶液
銅生銹會生成堿式碳酸銅,而工業上所制得的堿式碳酸銅種類較多,其組成表示為:xCuCO3?yCu(OH)2?zH2O。
【資料】:xCuCO3?yCu(OH)2?zH2O加熱至200℃時會分解得到氧化銅,二氧化碳和水。為進一步確定固體的組成,興趣小組同學準確稱量了25.8g的樣品,充分加熱(200℃)至質量不再改變,并將產生的氣體全部緩緩通過如圖(選填“甲”或“乙”)裝置,測得生成氣體的質量。
實驗數據:
①加熱后剩余固體質量16.0g;②濃硫酸增重5.4g;③濃NaOH溶液增重4.4g。
該堿式碳酸銅的化學式是。(寫出詳細的計算過程)組卷:84引用:1難度:0.2


