2009-2010學年湖南省長沙市長郡中學高二(上)化學課后作業(yè)(化學平衡常數(shù)的計算)
發(fā)布:2024/4/20 14:35:0
一、解答題(共5小題,滿分0分)
-
1.黃鐵礦(主要成分為FeS2)是工業(yè)制取硫酸的重要原料,其煅燒產物為SO2和Fe3O4.
(1)將0.050molSO2(g)和0.030molO2(g)放入容積為1L的密閉容器中,反應:2SO2(g)+O2(g)?2SO3(g)在一定條件下達到平衡,測得c(SO3)=0.040mol/L.計算該條件下反應的平衡常數(shù)K和SO2的平衡轉化率(寫出計算過程).
(2)已知上述反應是放熱反應,當該反應處于平衡狀態(tài)時,在體積不變的條件下,下列措施中有利于提高SO2平衡轉化率的有(填字母)
A、升高溫度 B、降低溫度 C、增大壓強(壓縮)
D、減小壓強 E、加入催化劑 G、移出氧氣.組卷:23引用:2難度:0.3
一、解答題(共5小題,滿分0分)
-
4.在一定體積的密閉容器中,進行如下化學反應:A(g)+3B(g)?2C(g)+D(s)△H,其化學平衡常數(shù)K與溫度t的關系如下表:
請完成下列問題:t/K 298 398 498 … K/(mol?L-1)-2 4.1×106 8.2×107 K1 …
該反應的化學平衡常數(shù)表達式為K=.
判斷該反應的△H0(填“>”或“<”)
在一定條件下,不能判斷該反應已達化學平衡狀態(tài)的是(填序號).
A.3v(B)(正)=2v(C)(逆)B.D的物質的量不變C.容器內壓強保持不變D.混合氣體的密度保持不變.組卷:24引用:1難度:0.5 -
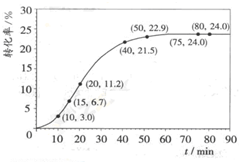 5.甲酸甲酯水解反應方程式為:HCOOCH3(l)+H2O(l)?HCOOH(l)+CH3OH(l);△H>0
5.甲酸甲酯水解反應方程式為:HCOOCH3(l)+H2O(l)?HCOOH(l)+CH3OH(l);△H>0
某小組通過試驗研究該反應(反應過程中體積變化忽略不計).反應體系中各組分的起始量如表:
甲酸甲酯轉化率在溫度T1下隨反應時間(t)的變化如圖:組分 HCOOCH3 H2O HCOOH CH3OH 物質的量/mol 1.00 1.99 0.01 0.52
(1)根據(jù)上述條件,計算不同時間范圍內甲酸甲酯的平均反應速率,結果見下表:
請計算15-20min范圍內甲酸甲酯的減少量為反應時間范圍/min 0~5 10~15 20~25 30~35 40~45 50~55 75~80 平均反應速率/(10-3mol?min-1) 1.9 7.4 7.8 4.4 1.6 0.8 0.0 mol,甲酸甲酯的平均反應速率為mol?min-1.
(2)依據(jù)以上數(shù)據(jù),寫出該反應的反應速率在不同階段的變化規(guī)律及其原因:.
(3)上述反應的平衡常數(shù)表達式為:K=,則該反應在溫度T1下的K值為c(HCOOH)?c(CH3OH)c(HCOOCH3)?c(H2O).組卷:14引用:1難度:0.3


