2021-2022學年吉林省四平市普通高中高二(上)期中化學試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題(1-10小題,每小題2分,11-20小題,每小題2分,共50分。每小題只有一個選項符合題意)
-
1.已知25℃時①HNO2、②HClO、③HCN的電離常數(shù)依次為7.24×10-4、2.90×10-8、6.17×10-10,該溫度下相同濃度的上述三種酸溶液,酸性由強到弱的順序正確的是( )
A.③>②>① B.①>②>③ C.①>③>② D.②>①>③ 組卷:21引用:1難度:0.7 -
2.已知醋酸溶液中存在CH3COOH?CH3COO-+H+ΔH>0,下列說法正確的是( )
A.常溫下,醋酸溶液的pH大于7 B.升高溫度,平衡逆向移動 C.加入少量CH3COONa固體,溫度保持不變,平衡常數(shù)減小 D.加入少量NaOH固體,平衡正向移動,CH3COO-濃度增大 組卷:21引用:1難度:0.6 -
3.化學反應(yīng)進行的方向是一個比較復雜的問題。下列有關(guān)說法正確的是( )
A.反應(yīng)SO3(g)+H2O(1)═H2SO4(1)的ΔS>0 B.1molCO2在不同狀態(tài)時的熵值:S[CO2(g)]<S[CO2(s)] C.反應(yīng)2N2O5(g)═4NO2(g)+O2(g) ΔH>0能否自發(fā)進行與溫度有關(guān) D.ΔH<0或ΔS>0的反應(yīng)一定能自發(fā)進行 組卷:25引用:8難度:0.5 -
 4.意大利羅馬大學的Fulvio Cacace等人獲得了極具理論研究意義的N4分子。N4分子結(jié)構(gòu)如圖,已知斷裂1mol N≡N鍵吸收942kJ熱量,生成1molN-N鍵釋放167kJ熱量根據(jù)以上信息和數(shù)據(jù),下列熱化學方程式正確的是( )
4.意大利羅馬大學的Fulvio Cacace等人獲得了極具理論研究意義的N4分子。N4分子結(jié)構(gòu)如圖,已知斷裂1mol N≡N鍵吸收942kJ熱量,生成1molN-N鍵釋放167kJ熱量根據(jù)以上信息和數(shù)據(jù),下列熱化學方程式正確的是( )A.2N2=N4ΔH=-882kJ?mol-1 B.N2 (g)=0.5N4(g)ΔH=+441kJ C.N2 (g)=0.5N4(g)ΔH=-441kJ?mol-1 D.2N2(g)=N4(g)ΔH=+882kJ?mol-1 組卷:73引用:12難度:0.6 -
5.下列事實能用化學平衡移動原理解釋的是( )
①光照新制的氯水時,溶液的pH逐漸減小;
②在鉑銠合金催化下縮短N2和H2合成氨的時間;
③可用濃氨水和氫氧化鈉固體快速制取氨氣;
④紅棕色的NO2,加壓后顏色先變深后變淺;
⑤對容積可變的密閉容器中已達平衡的HI、I2、H2混合氣體進行壓縮,混合氣體顏色變深;
⑥打開可樂瓶蓋后看到有大量氣泡逸出;
⑦實驗室中常用排飽和食鹽水的方法收集Cl2A.①②④⑥⑦ B.①③④⑥⑦ C.①③④⑤⑥⑦ D.①④⑤⑥⑦ 組卷:14引用:1難度:0.5 -
6.關(guān)節(jié)炎的成因是在關(guān)節(jié)滑液中形成尿酸鈉晶體--NaUr,其平衡關(guān)系為:Ur-(aq)+Na+(aq)?NaUr(s),其中Ur-表示尿酸根離子。醫(yī)生常囑咐關(guān)節(jié)炎病人要注意保暖,特別是手腳等離心臟較遠的部位。因為第一次關(guān)節(jié)炎的發(fā)作大都在手指或腳趾的關(guān)節(jié)處。這說明( )
A.形成尿酸鈉晶體的反應(yīng)為放熱反應(yīng) B.形成尿酸鈉晶體的反應(yīng)為吸熱反應(yīng) C.尿酸鈉溶解度較大 D.尿酸鈉晶體一定難溶于水 組卷:11引用:5難度:0.6 -
7.在密閉容器中投入足量CaC2O4,在T℃發(fā)生反應(yīng):CaC2O4(s)?CaO(s)+CO2(g)+CO(g),達到平衡時測得c(CO)=amol?L-1。保持溫度不變,壓縮體積至原來的一半,達到新平衡時測得c(CO2)為( )
A.0.5amol?L-1 B.a(chǎn)mol?L-1 C.1.5amol?L-1 D.2amol?L-1 組卷:34引用:11難度:0.8 -
8.下列說法正確的是( )
①增加水的量或溫度,都可以加快鎂跟水的反應(yīng)速率。
②增加硫酸的濃度,一定可以加快鋅與硫酸反應(yīng)制取氫氣的速率。
③對反應(yīng)3H2(g)+N2(g)?2NH3(g),在一密閉容器中進行,充入氦氣,則化學反應(yīng)速率一定不改變。
④對于反應(yīng)3KSCN(aq)+FeCl3(aq)?Fe(SCN)3(aq)+3KC l(aq),加入KCl固體,逆反應(yīng)速率瞬時增大,隨后正反應(yīng)速率增大。A.①② B.①④ C.②④ D.無 組卷:228引用:6難度:0.5
二、填空題(4小題,共50分)
-
23.某同學用50mL 0.50mol/L的鹽酸與50mL 0.55mol/L的NaOH溶液在如圖1所示的裝置中進行中和反應(yīng),通過測定反應(yīng)過程中所放出的熱量計算中和熱。
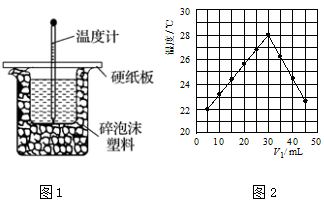
(1)如圖2裝置缺少一種玻璃儀器,該儀器的名稱為。
(2)寫出表示該反應(yīng)中和熱(-57.3kJ?mol-1)的熱化學方程式。
(3)中和熱的測定實驗中,下列情況會導致測出來的中和熱的數(shù)值偏小的是。
①大小燒杯口未相平
②大燒杯上未蓋硬紙板
③用環(huán)形銅絲攪拌棒攪拌反應(yīng)混合溶液
④用測量鹽酸的溫度計直接測定NaOH溶液的溫度
⑤做實驗時當天溫度室溫較高
(4)將一定量的稀氨水、稀氫氧化鈉溶液、稀氫氧化鋇溶液分別和1 L 1 mol?L-1的稀鹽酸恰好完全反應(yīng),其反應(yīng)熱分別為ΔH1、ΔH2、ΔH3,則ΔH1、ΔH2、ΔH3的大小關(guān)系為;
(4)實驗小組另取V1mL0.50mol?L-1HCl溶液和V2mL未知濃度的NaOH溶液混合均勻后測量并記錄溶液溫度,實驗結(jié)果如圖2所示(實驗中始終保持V1+V2=50mL)。則實驗小組做該實驗時的環(huán)境溫度(填“高于”“低于”或“等于”)22℃。組卷:86引用:2難度:0.1 -
 24.CH4-CO2催化重整反應(yīng)為:CH4(g)+CO2(g)?2CO(g)+2H2(g)ΔH=+247kJ/mol該原理不僅可以得到合成氣(CO和H2),還對溫室氣體的減排具有重要意義。回答下列問題:
24.CH4-CO2催化重整反應(yīng)為:CH4(g)+CO2(g)?2CO(g)+2H2(g)ΔH=+247kJ/mol該原理不僅可以得到合成氣(CO和H2),還對溫室氣體的減排具有重要意義。回答下列問題:
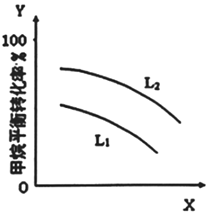
(1)L(L1、L2)、X可分別代表壓強或溫度。如圖表示L一定時,CH4-CO2催化重整反應(yīng)中CH4(g)的平衡轉(zhuǎn)化率隨X的變化關(guān)系。
X代表的物理量是;判斷L1、L2的大小關(guān)系L1L2(填”>或、“<”“=”),并簡述理由。
(2)某溫度下,在體積為2L的容器中加入2molCH4、1moCO2以及催化劑進行重整反應(yīng),經(jīng)過2min達到平衡狀態(tài)時測得CO2的轉(zhuǎn)化率是50%。
①反應(yīng)達到平衡狀態(tài)的標志是(填字母)。
A.單位時間內(nèi)生成nmol的CH4的同時,生成nmol的H2
B.c(CH4):c(CO2):c(CO):c(H2)=1:1:2:2
C.反應(yīng)體系中氣體的總物質(zhì)的量不變
D.容器中的混合氣體密度不再發(fā)生變化
②平均化學反應(yīng)速率v(CH4)=mol?L-1?min-1;其平衡常數(shù)為mol2?L-2;
若其它條件不變增大壓強,則合成反應(yīng)的化學平衡常數(shù)(填“變大”、“變小”或“不變”)。組卷:3引用:1難度:0.5


