滬教版九年級(jí)上冊(cè)《5.2 金屬礦物 鐵的冶煉》2022年同步練習(xí)卷(2)
發(fā)布:2024/4/20 14:35:0
一.選擇題(共8小題)
-
1.利用甲酸(HCOOH)與濃硫酸制備CO,并用如圖實(shí)驗(yàn)裝置驗(yàn)證CO的有關(guān)性質(zhì)。已知:HCOOH
CO↑+H2O,下列說法不正確的是( )60~80℃濃硫酸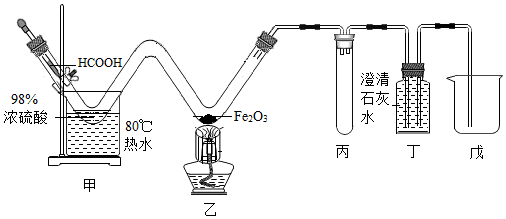
A.裝置丙的作用是防止倒吸 B.裝置丁既可檢驗(yàn)CO2,又可收集CO C.操作時(shí),先點(diǎn)燃乙處酒精燈,再滴加HCOOH D.隨著反應(yīng)進(jìn)行,濃硫酸濃度降低,產(chǎn)生CO氣體速率減小 組卷:939引用:6難度:0.3 -
 2.如圖為CO還原Fe2O3的微型實(shí)驗(yàn)裝置(夾持儀器已略去),甲酸在熱的濃硫酸作用下分解生成CO,利用CO還原Fe2O3。(已知:HCOOHH2O+CO↑)下列有關(guān)該實(shí)驗(yàn)的說法錯(cuò)誤的是( )濃H2SO4△
2.如圖為CO還原Fe2O3的微型實(shí)驗(yàn)裝置(夾持儀器已略去),甲酸在熱的濃硫酸作用下分解生成CO,利用CO還原Fe2O3。(已知:HCOOHH2O+CO↑)下列有關(guān)該實(shí)驗(yàn)的說法錯(cuò)誤的是( )濃H2SO4△A.此裝置內(nèi)空間較小,空氣易排盡,實(shí)驗(yàn)危險(xiǎn)系數(shù)小 B.此實(shí)驗(yàn)裝置的主要優(yōu)點(diǎn)是尾氣處理有效節(jié)能 C.該實(shí)驗(yàn)中CO既表現(xiàn)出還原性,又表現(xiàn)出可燃性 D.該實(shí)驗(yàn)中觀察到的現(xiàn)象是紅色固體變成了銀白色,澄清石灰水變渾濁 組卷:181引用:3難度:0.5 -
3.鈦(Ti)具有硬度大、密度小、熔點(diǎn)高、抗腐蝕性等優(yōu)良性能,被譽(yù)為“未來金屬”.鈦鐵礦石的主要成分是鈦酸亞鐵(FeTiO3).冶煉金屬鈦時(shí),主要發(fā)生以下兩個(gè)反應(yīng):①2FeTiO3+6C+7Cl2
2X+2TiCl4+6CO,②TiCl4+2Mg高溫Ti+2MgCl2,下列有關(guān)說法正確的是( )Ar800℃A.鈦酸亞鐵中Ti顯+3價(jià) B.①式中“X”的化學(xué)式為FeCl2 C.冶煉得到的單質(zhì)Ti的質(zhì)量與2FeTiO3中Ti中Ti元素的質(zhì)量相等 D.反應(yīng)②需在氬氣環(huán)境中進(jìn)行,這里氬氣作催化劑 組卷:1045引用:4難度:0.5 -
4.用一氧化碳還原氧化鐵的實(shí)驗(yàn)中,F(xiàn)e2O3轉(zhuǎn)化為鐵的具體過程是:Fe2O3
Fe3O4400℃-500℃FeO600℃-680℃Fe。已知鐵的氧化物除Fe2O3外,其余均為黑色。下列說法正確的是( )700℃-800℃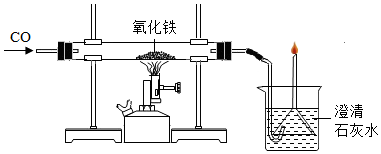
A.裝置中漏斗的主要作用是防止倒吸 B.實(shí)驗(yàn)中CO被氧化為CO2 C.操作時(shí),先點(diǎn)燃酒精噴燈,再通入CO氣體 D.通過硬質(zhì)玻璃管中的實(shí)驗(yàn)現(xiàn)象可以判斷氧化鐵是否完全轉(zhuǎn)化為鐵 組卷:199引用:2難度:0.5
二.填空題(共4小題)
-
11.金屬與人類生活密切相關(guān)。請(qǐng)分析回答下列問題:
(1)將黃銅片和純銅片相互刻畫,發(fā)現(xiàn)純銅片表面留下較深的劃痕,則它們的硬度大小關(guān)系是:黃銅純銅(填“>”“<”或“=”)。
(2)工業(yè)用赤鐵礦石煉鐵的反應(yīng)原理是:Fe2O3+3CO2Fe+3CO2,該反應(yīng)中體現(xiàn)了CO具有高溫性;為測(cè)定某赤鐵礦石中氧化鐵的質(zhì)量分?jǐn)?shù),用足量的一氧化碳與10g樣品充分反應(yīng)(雜質(zhì)不能反應(yīng)),若反應(yīng)后剩余固體質(zhì)量為m克,寫出計(jì)算該赤鐵礦石中氧化鐵質(zhì)量分?jǐn)?shù)的表達(dá)式(用m表示)。
(3)往AgNO3溶液中加入一定量鋅和銅的混合粉末,充分反應(yīng)后,過濾,濾液為藍(lán)色,則濾液中可能含有的金屬離子是(寫離子符號(hào)),濾渣中一定含有的金屬是(寫金屬名稱)。
(4)稀土元素銪是激光和原子能應(yīng)用的重要材料。已知三氯化銪的化學(xué)式為EuCl3,則氧化銪的化學(xué)式為。組卷:230引用:2難度:0.3 -
12.黃銅礦(主要成分的化學(xué)式是CuFeS2),下面是由黃銅礦冶煉純銅的主要工藝流程圖(流程中未涉及的雜質(zhì)發(fā)生的反應(yīng)不考慮)。

(1)步驟Ⅰ生成的硫化亞銅(Cu2S)中,銅元素的化合價(jià)為。
(2)步驟Ⅱ中發(fā)生的主要反應(yīng)如下:
①2FeS+3O22X+2SO2,其中X的化學(xué)式為高溫,X與SiO2反應(yīng)生成爐渣而除去。
②硫化亞銅與氧氣反應(yīng)生成氧化亞銅和二氧化硫,該反應(yīng)的化學(xué)方程式為。
③硫化亞銅與氧化亞銅反應(yīng):Cu2S+2Cu2O6Cu+SO2↑。步驟Ⅱ在開始反應(yīng)后,只需吹入空氣就可繼續(xù)進(jìn)行,不需另用燃料加熱,說明吹煉氧化時(shí)的反應(yīng)大多為高溫(填“放熱”或“吸熱”)反應(yīng)。組卷:91引用:1難度:0.6


