2023年河北省秦皇島市高考化學二模試卷
發布:2024/4/20 14:35:0
一、選擇題:本題共14小題,每小題3分,共42分,在每小題給出的四個選項中,只有
-
1.考古中出土的錫青銅(銅錫合金)文物常有Cu2(OH)3Cl覆蓋在其表面。下列說法正確的是( )
A.錫青銅的熔點比純銅高 B.錫青銅文物在潮濕環境中的腐蝕比干燥環境中快 C.錫青銅中的錫加速了銅的腐蝕速度 D.生成Cu2(OH)3Cl覆蓋物是電化學腐蝕過程,但不是化學反應過程 組卷:34引用:2難度:0.7 -
2.化學與科技、生活密切相關,下列說法正確的是( )
A.將二氧化硫添加于紅酒中可以起到殺菌和抗氧化作用 B.地下鋼鐵管道用導線連接銅塊可以減緩管道的腐蝕 C.將“84消毒液”與75%的酒精混合使用,消毒效果更好 D.“中國天眼”使用的高性能碳化硅是一種新型的有機高分子材料 組卷:62引用:4難度:0.7 -
3.下列說法正確的是( )
A.用丁達爾效應區分溶液與膠體 B.用濃硫酸干燥碘化氫氣體 C.用乙醇萃取碘水中的碘 D.用分液漏斗可分離溴苯和溴的混合物 組卷:21引用:3難度:0.7 -
4.下列實驗中硫酸的作用與其他三項不同的是( )
A.蔗糖中加入濃硫酸產生黑“面包” B.亞硫酸鈉與硫酸制取SO2 C.配制Fe2(SO4)3溶液時加入稀硫酸 D.海帶提碘時硫酸與雙氧水混加 組卷:91引用:3難度:0.7 -
5.學習小組用廢棄的鋁制易拉罐按如下流程制備明礬,并測定明礬中結晶水的含量。
上述實驗中不需要用到的操作是( )
A. 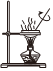
B. 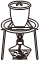
C. 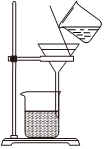
D. 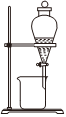 組卷:137引用:8難度:0.5
組卷:137引用:8難度:0.5 -
6.異黃酮類化合物是藥用植物的有效成分之一,一種異黃酮類化合物X的結構如圖所示。下列說法錯誤的是( )

A.X分子中環上氧原子的雜化方式為sp2 B.X分子中所有碳原子共平面 C.X分子中有6種不同化學環境的氫原子 D.1molX最多與3molBr2反應 組卷:83引用:4難度:0.6
二、非選擇題:本題共4小題,共58分。
-
17.氧化鑭(La2O3)在光學玻璃、陶瓷電容器、燃料電池等領域有廣泛應用,工業上通常將沉淀劑加入氯化鑭(LaCl3)溶液得水合碳酸鑭La2(CO3)3?xH2O,經灼燒獲得氧化鑭產品。
Ⅰ.水合碳酸鑭的制備
已知:制備水合碳酸鑭時,若溶液堿性太強會有堿式碳酸鑭[La(OH)CO3]生成。
(1)向氯化鑭溶液中加入適量碳酸氫銨溶液,控制溶液pH為6.5~7,充分攪拌后陳化2h,洗滌數次,真空抽濾,得到水合碳酸鑭。
①制備La2(CO3)3?xH2O時不宜用Na2CO3溶液代替NH4HCO3溶液,其原因是。
②生成La2(CO3)3?xH2O的離子方程式為。
③證明La2(CO3)3?xH2O固體已洗滌干凈的實驗操作是。
(2)某興趣小組利用以下裝置模擬制備水合碳酸鑭。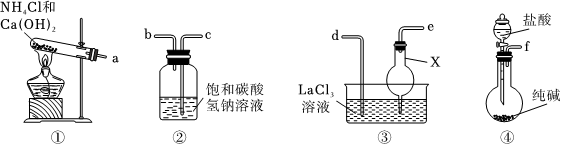
(Ⅰ).儀器X的名稱為;裝置接口的連接順序為af(填接口字母)。
(Ⅱ).灼燒水合碳酸鑭得La2O3固體。
(Ⅲ).EDTA滴定法測定La2O3(Mr=326)樣品純度。
已知:樣品中雜質不與EDTA反應;EDTA均可與La3+、Zn2+按1:1形成配合物;Zn2+遇二甲酚橙顯玫瑰紅色;La3+的EDTA配合物中加入NH4F后,EDTA會被重新釋放。
步驟1:準確稱取La2O3樣品m1g,用適量稀鹽酸溶解后,稀釋至250mL(待測液);
步驟2:取25mL待測液于錐形瓶中,加入V1mLc1mol?L-1EDTA(過量)充分反應;
步驟3:加入1滴二甲酚橙指示劑,用c2mol?L-1鋅標準液滴定剩余的EDTA至玫瑰紅色(不計數);
步驟4:加入0.5gNH4F(過量)放置10分鐘,釋放與鑭絡合的EDTA,用c2mol?L-1鋅標準液滴定至終點,消耗鋅標準液V2mL。
(3)實驗測得此樣品的純度為(用代數式表示);步驟4加入NH4F溶液后,若放置時間過短,會導致產品中La2O3純度測定值(填“偏低”“偏高”“無影響”)。組卷:22引用:4難度:0.6 -
18.空間站CO2還原轉化系統能把呼出的CO2捕集、分離并與空間站電解水系統產生的H2進行加氫處理,從而實現空間站內物料的循環利用。
(1)一種借助光將CO2轉化為CH4的催化機理如圖所示。該轉化過程總反應的化學方程式是;圖中所示的各物質中,含有極性共價鍵的非極性分子是(填化學式)。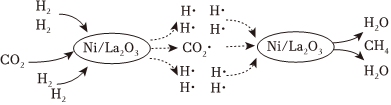
(2)一定條件下,CO2和H2還可發生如下兩個平行反應:
i.CO2(g)+H2(g)?CO(g)+H2O(g)ΔH1
ii.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)ΔH2=-49.5kJ?mol-1
①已知相關鍵能數據如下表:
則反應i的ΔH1=化學鍵 H-H H-O C=O C≡O 鍵能/kJ?mol-1 436 464 803 1072 kJ?mol-1。
②為了提高CH3OH的產率,理論上應采用的措施是(填標號)。
A.低溫低壓
B.高溫低壓
C.高溫高壓
D.低溫高壓
③保持溫度533K,壓強3MPa,按投料比向密閉容器中充入CO2和H2,反應相同時間測得不同催化劑下CO2轉化率和CH3OH選擇性的相關實驗數據如下表所示(已知CH3OH選擇性:轉化的CO2中生成CH3OH的百分比)。n(CO2)n(H2)=13
上述條件下,使用cat.2作催化劑,下列說法能判斷反應ii達到平衡狀態的是催化劑 CO2轉化率 CH3OH選擇性 cat.1 21.9% 67.3% cat.2 36.1% 100.0% (填標號)。
A.氣體壓強不再變化
B.氣體平均相對分子質量不再變化
C.CH3OH和H2O的物質的量之比為1:1
D.CO2和H2的物質的量之比不再變化
(3)一定條件下,向0.5L恒容密閉容器中充入1molCO2和3molH2,只發生上述反應ii,達平衡時,H2的轉化率為80%,則該溫度下的平衡常數K=(保留兩位小數)。
(4)若恒容密閉容器中只發生上述反應i,在進氣比n(CO2):n(H2)不同、溫度不同時,測得相應的CO2平衡轉化率如圖所示。則B和D兩點的溫度T(B)T(D)(填“<”,“>”,或“=”),其原因是。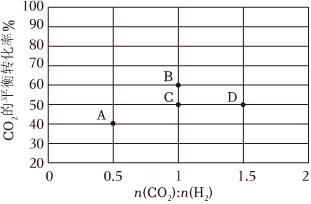 組卷:109引用:5難度:0.6
組卷:109引用:5難度:0.6


