2020-2021學(xué)年福建省泉州七中高二(上)期中化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題(每小題只有一個(gè)選項(xiàng)符合題意,本題包括18小題,1—10小題,每小題2分,11—18小題,每小題2分,共44分。)
-
1.生活與能量轉(zhuǎn)化息息相關(guān),下列圖示中主要能量轉(zhuǎn)化描述錯(cuò)誤的是( )
A.燃料電池電動(dòng)車 B.太陽(yáng)能風(fēng)扇 C.使用天然氣燃?xì)庠?/td> D.鑰匙鍍銅 


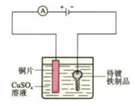
電能轉(zhuǎn)化為化學(xué)能 太陽(yáng)能轉(zhuǎn)化為電能 化學(xué)能轉(zhuǎn)化為熱能和光能 電能轉(zhuǎn)化為化學(xué)能 A.A B.B C.C D.D 組卷:3引用:1難度:0.7 -
2.中華傳統(tǒng)文化蘊(yùn)含著很多化學(xué)科學(xué)知識(shí),下列說(shuō)法錯(cuò)誤的是( )
A.“烈火焚燒若等閑”涉及的反應(yīng)在高溫下自發(fā)進(jìn)行 B.“水聲冰下咽,沙路雪中平”未涉及化學(xué)變化 C.“丹砂(HgS)燒之成水銀,積變又還成丹砂”描述的是可逆反應(yīng) D.“洪爐照破夜沉沉”中涉及的反應(yīng)是放熱反應(yīng) 組卷:3引用:2難度:0.8 -
3.下列化學(xué)反應(yīng)屬于吸熱反應(yīng)的是( )
A.鎂條與鹽酸反應(yīng) B.鋁熱反應(yīng) C.氯化銨與消石灰反應(yīng) D.生石灰加水 組卷:1引用:1難度:0.7 -
4.已知:H2(g)+
O2(g)=H2O(g)△H=-242kJ/mol,斷開(kāi)1 mol O=O鍵和1 molH-O鍵所吸收的能量分別為496 kJ和463kJ,則斷開(kāi)1 mol H-H鍵所吸收的能量為( )12A.920 kJ B.557 kJ C.436 kJ D.188 kJ 組卷:23引用:4難度:0.5 -
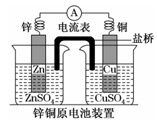 5.如圖是一個(gè)鹽橋中充滿飽和KCl溶液的鋅銅原電池裝置,下列分析正確的是( )
5.如圖是一個(gè)鹽橋中充滿飽和KCl溶液的鋅銅原電池裝置,下列分析正確的是( )A.電子由Cu片經(jīng)外電路流向Zn片 B.Zn片上發(fā)生還原反應(yīng) C.鹽橋中的K+移向CuSO4溶液 D.一段時(shí)間后燒杯中c(Zn2+)、c(Cu2+)均減小 組卷:6引用:1難度:0.4 -
6.下列說(shuō)法中,錯(cuò)誤的是( )
A.實(shí)驗(yàn)室用鐵片和稀硫酸制備H2時(shí),滴入幾滴CuSO4溶液,能加快反應(yīng)速率 B.鍍錫鐵皮表面有破損時(shí),鐵的腐蝕速率會(huì)加快 C.硫粉分別在純氧和空氣中燃燒,前者反應(yīng)更劇烈 D.酶作為催化劑,在任何溫度下均能極大地提高反應(yīng)速率 組卷:1引用:1難度:0.7 -
7.a、b、c、d四塊金屬片浸入稀硫酸中,用導(dǎo)線兩兩相連組成原電池。若a、c 相連時(shí),a極上產(chǎn)生大量氣泡,c、d相連時(shí),電流由c到d;b、d相連時(shí),H+移向d極,則四種金屬的活動(dòng)性順序由強(qiáng)到弱的順序?yàn)椋ā 。?/h2>
A.a(chǎn)>b>c>d B.a(chǎn)>c>d>b C.c>a>b>d D.b>d>c>a 組卷:34引用:4難度:0.7
二、填空題(本題共有5小題,共56分)
-
22.工業(yè)上煙氣脫硫可以較好地較少酸雨的產(chǎn)生,保護(hù)環(huán)境。已知:
Ⅰ.2CO(g)+SO2(g)S(g)+2CO2(g)ΔH=+8.0kJ?mol-1
Ⅱ.2H2(g)+SO2(g)S(g)+2H2O(g)ΔH=+90.4kJ?mol-1
請(qǐng)回答下列問(wèn)題:
(1)T1K下,向10L恒容密閉容器中充入1.0molCO和0.5molSO2,發(fā)生反應(yīng)Ⅰ。5min時(shí)達(dá)到平衡,測(cè)得0~5min內(nèi),用CO表示的反應(yīng)速率v(CO)=0.012mol?L-1?min-1。
①CO的平衡體積分?jǐn)?shù)為。
②下列情況不能說(shuō)明該反應(yīng)達(dá)到平衡狀態(tài)的是(填字母)。
A.容器內(nèi)氣體的密度不變
B.n(CO)與n(CO2)的比值不變
C.容器內(nèi)的總壓強(qiáng)不再變化
D.2v正(SO2)=v逆(CO2)
③若向平衡后的容器中充入1.0molCO和0.5molSO2,再次平衡后,SO2的轉(zhuǎn)化率α(SO2)(填“增大”、“減小”或“不變”)。
(2)若在密閉容器中充入2.0molH2和1.0molSO2,發(fā)生反應(yīng)Ⅱ。隨著溫度的變化,平衡時(shí)SO2(g)和S(g)的體積分?jǐn)?shù)變化如圖所示。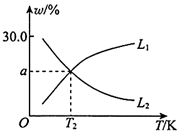
①a=(保留三位有效數(shù)字)。
②代表S(g)的體積分?jǐn)?shù)變化曲線為(填“L1”或“L2”,理由是。
③T2K下,向密閉容器中充入0.2molH2(g)、0.1molSO2(g)、0.2molS(g)和0.1molH2O(g),此時(shí)v(H2)消耗v(H2O)消耗(填“>”、“=”或“<”)。組卷:2引用:1難度:0.7 -
23.二氧化碳資源化利用是目前研究的熱點(diǎn)之一。回答下列問(wèn)題:
(1)1945年Ipatieff等首次提出可在銅鋁催化劑上用CO2(g)加氫合成醇。已知發(fā)生的主要反應(yīng)的熱化學(xué)方程式如下:
CO2(g)+H2(g)?CO(g)+H2O(g)ΔH1=+41.17kJ?mol-1
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)ΔH2=-49.47kJ?mol-1
CO(g)+2H2(g)?CH3OH(g) ΔH3
①ΔH3kJ?mol-1。
②CO2和H2以物質(zhì)的量之比為1:3通入某密閉容器中,若發(fā)生反應(yīng)CO2(g)+3H2(g)?CH3OH(g)+H2O(g),忽略副反應(yīng),CO2的平衡轉(zhuǎn)化率與溫度、氣體的總壓強(qiáng)的關(guān)系如圖所示,p1p2(填“大于”、“小于”或“等于”);圖中a點(diǎn)CO2的平衡分壓p(CO2)=MPa。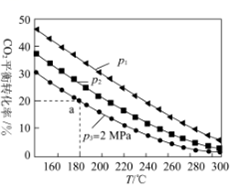
(2)CO2催化加氫合成二甲醚是一種CO2轉(zhuǎn)化方法,其過(guò)程中主要發(fā)生下列反應(yīng):
反應(yīng)Ⅰ:CO2(g)+H2(g)═CO(g)+H2O(g)ΔH=+41.2kJ?mol-1
反應(yīng)Ⅱ:2CO2(g)+6H2(g)═CH3OCH3(g)+3H2O(g)ΔH=-122.5kJ?mol-1
恒壓條件下,CO2和H2的起始量一定時(shí),CO2平衡轉(zhuǎn)化率和平衡時(shí)CH3OCH3的選擇性隨溫度的變化如圖。其中:CH3OCH3的選擇性=×100%2×CH3OCH3的物質(zhì)的量反應(yīng)的CO2的物質(zhì)的量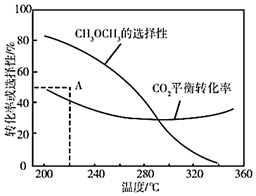
①溫度高于300°C,CO2平衡轉(zhuǎn)化率隨溫度升高而上升的原因是。
②220°C時(shí),在催化劑作用下CO2與H2反應(yīng)一段時(shí)間后,測(cè)得CH3OCH3的選擇性為48%(圖中A點(diǎn))。不改變反應(yīng)時(shí)間和溫度,一定能提高CH3OCH3選擇性的措施有。
(3)氫氣可將CO2還原為甲烷,反應(yīng)為CO2(g)+4H2(g)?CH4(g)+2H2O(g)。ShyamKattel等結(jié)合實(shí)驗(yàn)與計(jì)算機(jī)模擬結(jié)果,研究了在Pt/SiO2催化劑表面上CO2與H2的反應(yīng)歷程,前三步歷程如圖所示,其中吸附在Pt/SiO2催化劑表面上的物種用?標(biāo)注,Ts表示過(guò)渡態(tài)。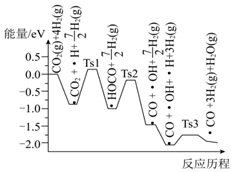
物質(zhì)吸附在催化劑表面,形成過(guò)渡態(tài)的過(guò)程會(huì)熱量(填“吸收”或“釋放”);反應(yīng)歷程中最大能壘(活化能)的步驟的化學(xué)方程式為。組卷:21引用:1難度:0.6


