2020-2021學年廣東省佛山二中高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本卷共20道題,每題3分,且每題僅有一個正確選項。)
-
1.下列設備工作時,將化學能轉化為熱能的是( )
A. 
硅太陽能電池B. 
鋰離子電池C. 
太陽能集熱器D. 
燃氣灶組卷:223引用:32難度:0.9 -
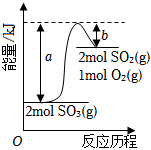 2.如圖是2SO3(g)?2SO2(g)+O2(g) 的能量變化圖,據圖得出的相關敘述正確的是( )
2.如圖是2SO3(g)?2SO2(g)+O2(g) 的能量變化圖,據圖得出的相關敘述正確的是( )A.該化學反應過程中既有能量的吸收又有能量的釋放 B.2SO3(g)?2SO2(g)+O2(g)△H=-(a-b) kJ/mol C.1mol SO2的能量比1mol SO3的能量高 D.若某容器內有2mol SO3充分反應,吸收(a-b) kJ熱量 組卷:31引用:7難度:0.6 -
3.下列依據熱化學方程式得出的結論正確的是( )
A.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3KJ/mol,則40gNaOH固體與稀鹽酸完全反應,放出的熱量即為57.3KJ B.已知C(s)+O2(g)=CO2(g)△H1 C(s)+ (g)=CO(g)△H2 則△H1<△H212O2C.已知H2(g)+Cl2(g)=2HCl,△H=-184.6KJ/mol,則反應物總能量小于生成物總能量 D.已知P(白磷,s)=P(紅磷,s)△H<0,則白磷比紅磷穩定 組卷:10引用:4難度:0.7 -
4.下列四幅圖示所表示的信息與對應的敘述相符的是( )
A. 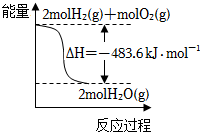
圖表示H2與O2發生反應過程中的能量變化,則H2的燃燒熱為241.8kJ?mol-1B. 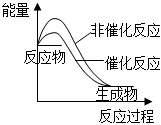
圖表示某吸熱反應分別在有、無催化劑的情況下反應過程中的能量變化C. 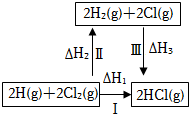
圖表示一定條件下H2和Cl2生產HCl的反應熱與途徑無關,則△H1=△H2+△H3D. 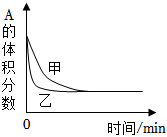
圖表示壓強對可逆反應2A(g)+2B(g)?3C(g)+D(s)的影響,乙的壓強大組卷:59引用:14難度:0.6 -
5.我國科研人員提出了由CO2和CH4轉化為高附加值產品CH3COOH的催化反應歷程,該歷程示意圖如圖所示。
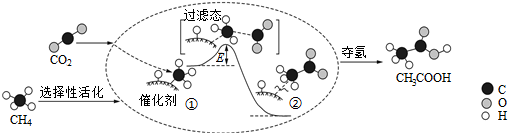
下列說法不正確的是( )A.生成CH3COOH總反應的原子利用率為100% B.CH4→CH3COOH過程中,有C-H鍵發生斷裂 C.①→②放出能量并形成了C-C鍵 D.該催化劑可有效提高反應物的平衡轉化率 組卷:137引用:36難度:0.7 -
6.反應A(g)+3B(g)?2C(g)+2D(g)在四種不同情況下的反應速率如下,其中表示反應速率最快的是( )
A.v(A)=0.15 mol?L-1?min-1 B.v(B)=0.01 mol?L-1?s-1 C.v(C)=0.40 mol?L-1?min-1 D.v(D)=0.0075 mol?L-1?s-1 組卷:29引用:5難度:0.7 -
7.下列裝置或操作能達到目的的是( )
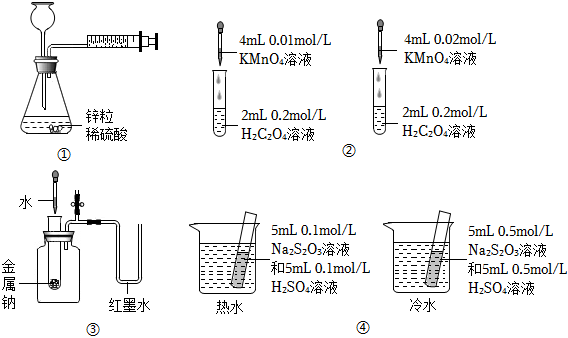
A.裝置①用于測定生成氫氣的速率 B.裝置②依據褪色快慢比較濃度對反應速率的影響 C.裝置③依據U管兩邊液面的高低判斷Na和水反應的熱效應 D.裝置④依據出現渾濁的快慢比較溫度對反應速率的影響 組卷:51引用:16難度:0.6 -
8.將4molA氣體和2molB氣體在2L的容器中混合并在一定條件下發生如下反應:2A(g)+B(g)?2C(g),2s后測得C的濃度為0.6mol?L-1,下列說法正確的是( )
A.用物質A表示的反應平均速率為0.6mol?L-1?s-1 B.v(B)=2v(C) C.2 s時物質A的轉化率為30% D.2 s時物質B的濃度為0.8mol?L-1 組卷:6引用:2難度:0.4
二.第II卷非選擇題
-
23.近年我國大力加強溫室氣體CO2催化氫化合成甲醇技術的工業化量產研究,實現可持續發展。
(1)已知:
CO2(g)+H2(g)?H2O(g)+CO(g)△H1=+41.1kJ?mol-1。
CO(g)+2H2(g)?CH3OH(g)△H2=-90.0kJ?mol-1。
寫出CO2催化氫化合成甲醇的熱化學方程式:。
(2)為提高CH3OH產率,理論上應采用的條件是(填字母)。
a.高溫高壓
b.低溫低壓
c.高溫低壓
d.低溫高壓
(3)溫度不變的密閉容器中發生上述反應,下列可以作為反應達到平衡的判據是。
A.氣體的壓強不變
B.3v正(H2)=v逆(CH3OH)
C.K不變
D.容器內氣體的密度不變E.容器內顏色不變
F.混合氣體的平均相對分子質量不變
(4)250℃、在恒容密閉容器中由CO2(g)催化氫化合成CH3OH(g),如圖為不同投料比[n(H2)/n(CO2)]時某反應物X平衡轉化率變化曲線。
反應物X是(填“CO2”或“H2”)。
(5)250℃、在體積為2.0L的恒容密閉容器中加入6mol H2、2mol CO2和催化劑,10min時反應達到平衡,測得c(CH3OH)=0.75mol?L-1。
①化學平衡常數K=。
②催化劑和反應條件與反應物轉化率和產物的選擇性有高度相關。控制相同投料比和相同反應時間,四組實驗數據如下:
根據上表所給數據,用CO2生產甲醇的最優選項為實驗編號 溫度(K) 催化劑 CO2轉化率(%) 甲醇選擇性(%) A 543 Cu/ZnO納米棒 12.3 42.3 B 543 Cu/ZnO納米片 11.9 72.7 C 553 Cu/ZnO納米棒 15.3 39.1 D 553 Cu/ZnO納米片 12.0 70.6 (填字母)。組卷:19引用:2難度:0.7 -
 24.使用酸堿中和滴定法測定市售白醋的總酸量(g/100mL).
24.使用酸堿中和滴定法測定市售白醋的總酸量(g/100mL).
Ⅰ.實驗步驟:
(1)配制100mL待測白醋溶液.量取10.00mL食用白醋,注入燒杯中用水稀釋后轉移到(填儀器名稱)中定容,搖勻即得.
(2)取待測白醋溶液20.00mL于錐形瓶中,向其中滴加2滴作指示劑.
(3)讀取盛裝0.1000mol/L NaOH 溶液的(填儀器名稱)的初始讀數.
如果液面位置如右圖所示,則此時的讀數為mL.
(4)滴定.當時,停止滴定,
并記錄NaOH溶液的終讀數.重復滴定3次.
Ⅱ.實驗記錄
Ⅲ.數據處理與討論:滴定次數
實驗數據(mL)1 2 3 4 V(樣品) 20.00 20.00 20.00 20.00 V(NaOH)(消耗) 15.95 15.00 15.05 14.95
(1)經計算,市售白醋總酸量=g/100mL.
(2)在本實驗的滴定過程中,下列操作會使實驗結果偏大的是(填寫序號)
a.堿式滴定管在滴定時未用標準NaOH溶液潤洗
b.堿式滴定管在尖嘴在滴定前有氣泡,滴定后氣泡消失
c.錐形瓶中加入待測白醋溶液后,再加少量水
d.錐形瓶在滴定時距離搖動,有少量液體濺出.組卷:59引用:3難度:0.1


