2021-2022學年山西省運城市康杰中學高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本大題共15小題,每小題2分,共計30分。在每小題列出的四個選項中,只有一項是符合題目要求的)
-
1.頁巖氣是蘊藏于頁巖層可供開采的天然氣資源,頁巖氣的開采利用在近十年里發展很快,下列有關頁巖氣的說法中正確的是( )
A.屬于清潔能源 B.屬于二次能源 C.屬于可再生能源 D.頁巖氣燃燒不會產生溫室氣體 組卷:0引用:1難度:0.7 -
2.KH具有強還原性,其與水反應的化學方程式為KH+H2O═KOH+H2↑,下列化學用語正確的是( )
A.H-的結構示意圖為 
B.KOH的電子式為 
C.H2O的結構式為H-H-O D.H2、H3互為同素異形體 組卷:13引用:2難度:0.6 -
3.貯氫技術是氫氣作燃料的一大難題。有報道稱锏(La)一鎳(Ni)合金材料LaNi4有較大貯氫容量,其原理為LaNi4(s)+3H2 (g)?LaNi4H6(s) ΔH=-31.8kJ?mol-1。下列條件有利于該合金貯氫的是( )
A.高溫、低壓 B.低溫、高壓 C.高溫、高壓 D.低溫、低壓 組卷:7引用:4難度:0.6 -
4.25℃、101kPa下,碳、氫氣、甲烷和葡萄糖的燃燒熱依次是393.5kJ?mol-1、285.8kJ?mol-1、890.3kJ?mol-1、2800kJ?mol-1,則下列熱化學方程式正確的是( )
A.C(s)+ O2(g)═CO(g)△H=-393.5kJ?mol-112B.2H2(g)+O2(g)═2H2O(g)△H=+571.6kJ?mol-1 C.CH4(g)+2O2(g)═CO2( g)+2H2O(g)△H=-890.3kJ?mol-1 D. C6H12O6(s)+3 O2(g)═3 CO2 (g)+3H2O(1)△H=-1400kJ?mol-112組卷:30引用:3難度:0.8 -
 5.已知CO(g)與H2O(g)反應前后的能量變化如圖所示。一定溫度下,在容積為2L恒容密閉容器中,充入4molCO和6molH2O(g),反應達到平衡后,測得CO2的濃度為1.2mol?L-1,則反應達到平衡時放出的熱量為( )
5.已知CO(g)與H2O(g)反應前后的能量變化如圖所示。一定溫度下,在容積為2L恒容密閉容器中,充入4molCO和6molH2O(g),反應達到平衡后,測得CO2的濃度為1.2mol?L-1,則反應達到平衡時放出的熱量為( )A.33.2kJ B.66.4kJ C.79.68kJ D.88.6kJ 組卷:2引用:2難度:0.7 -
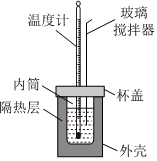 6.已知:H+(aq)+OH-(aq)═H2O(l)ΔH=-57.3kJ?mol-1。某同學使用如圖所示的裝置測定中和熱。下列關于該實驗的說法錯誤的是( )
6.已知:H+(aq)+OH-(aq)═H2O(l)ΔH=-57.3kJ?mol-1。某同學使用如圖所示的裝置測定中和熱。下列關于該實驗的說法錯誤的是( )A.測定一次至少需要測量并記錄三次溫度 B.若用銅棒代替玻璃攪拌器,測得的ΔH小于-57.3kJ?mol-1 C.若用濃硫酸替代稀鹽酸進行實驗,測得的ΔH小于-57.3kJ?mol-1 D.該實驗需要計算生成水的物質的量 組卷:97引用:7難度:0.8 -
7.下列事實中,不能用勒夏特列原理解釋的是( )
A.鋼鐵在潮濕的空氣中容易生銹 B.開啟啤酒后,瓶中馬上泛起大量泡沫 C.實驗室中常用排飽和食鹽水的方法收集氯氣 D.工業生產硫酸的過程中使用過量的空氣以提高二氧化硫的利用率(2SO2+O2?2SO3) 組卷:23引用:3難度:0.5 -
8.氯氣-鋁電池是一種新型的燃料電池,若電解質溶液為KOH溶液,則下列說法中不正確的是( )
A.通入氯氣的電極是正極 B.電池工作時,電子從Al電極流出 C.負極反應為2Al-6e-+8OH-═2AlO2-+4H2O D.該電池總反應為3Cl2+2Al═2AlCl3 組卷:7引用:2難度:0.5 -
 9.在1L密閉容器中,用足量的CaCO3與100mL稀鹽酸反應制取CO2,反應生成CO2的體積隨時間的變化關系如圖所示(CO2的體積已按標準狀況折算),下列分析不正確的是( )
9.在1L密閉容器中,用足量的CaCO3與100mL稀鹽酸反應制取CO2,反應生成CO2的體積隨時間的變化關系如圖所示(CO2的體積已按標準狀況折算),下列分析不正確的是( )A.EF段反應速率加快的原因是反應體系的溫度上升 B.FG段反應速率減慢的原因是稀鹽酸的濃度不斷減小 C.EF段,用鹽酸表示該反應的平均反應速率為0.04mol?L-1?min-1 D.OE、EF、FG三段中,用CO2表示的平均反應速率之比為2:4:1 組卷:114引用:4難度:0.7
三、非選擇題(本題共4小題,共40分)
-
28.一定條件下,CH4與CO2反應可制備CH3COOH,反應的熱化學方程式為CH4(g)+CO2(g)═CH3COOH(g )
,ΔH=+37.9kJ?mol-1。回答下列問題:
(1)若上述反應在恒容密閉容器中進行,則下列情況能說明反應已經達到平衡狀態的是(填字母,下同)。
a.容器內氣體密度保持不變
b.CO2的體積分數保持不變
c.該反應的平衡常數保持不變
d.混合氣體的平均相對分子質量不變
(2)下列措施既能提高CH4的平衡轉化率又能加快反應速率的是。
a.升高溫度
b.使用高效催化劑
c.加入CH4
d.擴大容器體積
(3)T1℃時催化劑作用下,將體積比為1:1的CH4與CO2混合氣體充入恒容密閉容器中反應生成CH3COOH(g),每隔一定時間測得容器內氣體壓強如表所示:
①已知:v[p(B)]=時間/min 0 10 20 30 40 50 壓強/kPa 2 1.5 1.3 1.2 1.2 1.2 。反應開始10min內,用CH4的壓強變化表示該反應的平均反應速率為△p(B)△tkPa?min-1。
②T1℃時,反應的平衡常數Kp=kPa-1(Kp為用各氣體分壓表示的平衡常數,分壓=總壓×物質的量分數)。
(4)用Co作催化劑,可使反應CH4(g)+CO2(g)?CH3COOH(g)在較溫和條件下進行,反應歷程如圖:
①第二步反應的化學方程式為。
②為增大CH3COOH的平衡產率:從溫度角度考慮,第一步反應在高溫下進行,第二步反應在進行;從H2濃度的角度考慮,第二步應采取的措施是。組卷:11引用:2難度:0.4 -
29.電解質水溶液中存在電離平衡、水解平衡,已知部分弱電解質的電離常數如下表:
回答下列問題:弱酸 HCOOH HClO H2CO3 NH3?H2O 電離常數(25°C) Ka=1.77×10-4 Ka=4.3×10-10 Ka1=5.0×10-7
Ka2=5.6×10-11Kb=1.75×10-5
(1)0.1mol?L-1的NaClO溶液和0.1mol?L-1的Na2CO3溶液中,c(ClO-)(填“>”“<”或“=”)c(CO32-)。
(2)HCOO-、ClO-、CO32-、HCO3-中,結合質子能力最強的是,將少量CO2通入NaClO溶液,反應的離子方程式是。
(3)將體積相同,pH=5的HCOOH和pH=5的H2SO4,加水稀釋到pH=6,需水的體積:HCOOH(填“大于”“小于”或者“等于”,下同)H2SO4;分別與足量的鋅粉反應,反應過程中的平均反應速率:HCOOHH2SO4
(4)25°C時,0.01mol?L-1的HCOOH和0.01mol?L-1的氨水等體積混合后溶液呈(填“酸”或“堿”)性;若amol?L-1的HCOOH與0.01mol?L-1的NaOH溶液等體積混合,所得溶液中c(HCOO-)=c(Na+),則該溫度下HCOOH的電離常數Ka=(用含a的代數式表示)。組卷:11引用:1難度:0.6


