人教版選修4《第4章 電化學基礎》2009年單元測試卷(湖南省長沙市長郡中學)
發布:2024/11/5 22:0:2
一、選擇題(共4小題,每小題3分,滿分12分)
-
1.可用于電動汽車的鋁-空氣燃料電池,通常以NaCl溶液或NaOH溶液為電解液,鋁合金為負極,空氣電極為正極.下列說法正確的是( )
A.以NaCl溶液或NaOH溶液為電解液時,正極反應都為:O2+2H2O+4e-=4OH- B.以NaOH溶液為電解液時,負極反應為:Al+3OH--3e-=Al(OH)3↓ C.以NaOH溶液為電解液時,電池在工作過程中電解液的pH保持不變 D.電池工作時,電子通過外電路從正極流向負極 組卷:700引用:65難度:0.9 -
2.市場上經常見到的標記為Li-ion的電池稱為“鋰離子電池”.
它的負極材料是金屬鋰和碳的復合材料(碳作為金屬鋰的載體),電解質為一種能傳導Li+的高分子材料.這種鋰離子電池的電池反應式為:Li+2Li0.35NiO2 2Li0.85NiO2下列說法不正確的是( )
2Li0.85NiO2下列說法不正確的是( )A.放電時,負極的電極反應式:Li-e-=Li+ B.充電時,Li0.85NiO2既發生氧化反應又發生還原反應 C.該電池不能用水溶液作為電解質 D.放電過程中Li+向負極移動 組卷:125引用:10難度:0.7 -
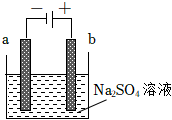 3.如圖為直流電源電解稀Na2SO4水溶液的裝置。通電后在石墨電極a和b附近分別滴加幾滴石蕊溶液。下列實驗現象中正確的是( )
3.如圖為直流電源電解稀Na2SO4水溶液的裝置。通電后在石墨電極a和b附近分別滴加幾滴石蕊溶液。下列實驗現象中正確的是( )A.逸出氣體的體積,a電極的小于b電極的 B.一電極逸出無味氣體,另一電極逸出刺激性氣味氣體 C.a電極附近呈紅色,b電極附近呈藍色 D.a電極附近呈藍色,b電極附近呈紅色 組卷:458引用:63難度:0.7 -
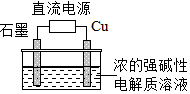 4.Cu2O是一種半導體材料,基于綠色化學理念設計的制取Cu2O的電解池示意圖如圖,電解總反應:2Cu+H2OCu2O+H2↑.下列說法正確的是( )通電
4.Cu2O是一種半導體材料,基于綠色化學理念設計的制取Cu2O的電解池示意圖如圖,電解總反應:2Cu+H2OCu2O+H2↑.下列說法正確的是( )通電A.石墨電極上產生氫氣 B.銅電極發生還原反應 C.銅電極接直流電源的負極 D.當有0.1mol電子轉移時,有0.1molCu2O生成 組卷:475引用:56難度:0.7
二、解答題(共2小題,滿分15分)
-
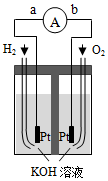 5.氫氧燃料電池是符合綠色化學理念的新型發電裝置.圖為電池示意圖,該電池電極表面鍍一層細小的鉑粉,附氣體的能力強,性質穩定,請回答:
5.氫氧燃料電池是符合綠色化學理念的新型發電裝置.圖為電池示意圖,該電池電極表面鍍一層細小的鉑粉,附氣體的能力強,性質穩定,請回答:
(1)氫氧燃料電池的能量轉化主要形式是,在導線中電子流動方向為(用a、b表示).
(2)負極反應式為.
(3)該電池工作時,H2和O2連續由外部供給,電池可連續不斷提供電能.因此,大量安全儲氫是關鍵技術之一,金屬鋰是一種重要的儲氫材料,吸氫和放氫原理如下:
Ⅰ.2Li+H22LiH△
Ⅱ.LiH+H2O═LiOH+H2↑
①反應Ⅰ中的還原劑是,反應Ⅱ中的氧化劑是.
②已知LiH固體密度為 0.82g/cm3.用鋰吸收 224L(標準狀況)H2,生成的LiH體積與被吸收的H2體積比為.
③由②生成的LiH與H2O作用放出的H2用作電池燃料,若能量轉化率為80%,則導線中通過電子的物質的量為.組卷:319引用:27難度:0.3 -
6.右圖所示裝置中,甲、乙、丙三個燒杯依次分別盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,電極均為石墨電極.
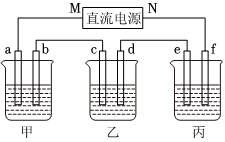
(1)接通電源,經過一段時間后,測得丙中K2SO4濃度為10.47%,乙中c電極質量增加.據此回答問題:
①電源的N端為極;
②電極b上發生的電極反應為;
③列式計算電極b上生成的氣體在標準狀況下的體積:
④電極c的質量變化是g;
⑤電解前后各溶液的酸、堿性大小是否發生變化,簡述其原因:
甲溶液;
乙溶液;
丙溶液;
(2)如果電解過程中銅全部析出,此時電解能否繼續進行,為什么?.組卷:266引用:24難度:0.3
四、解答題(共2小題,滿分0分)
-
17.Li-SOCl2電池可用于心臟起搏器.該電池的電極材料分別為鋰和碳,電解液是LiAlCl4-SOCl2.電池的總反應可表示為:4Li+2SOCl2=4LiCl+S+SO2.
請回答下列問題:
(1)電池的負極材料為,發生的電極反應為;
(2)電池正極發生的電極反應為;
(3)SOCl2易揮發,實驗室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成. 如果把少量水滴到SOCl2中,實驗現象是,反應的化學方程式為;
(4)組裝該電池必須在無水、無氧的條件下進行,原因是.組卷:727引用:37難度:0.5 -
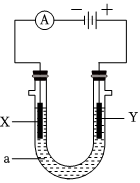 18.電解原理在化學工業中有廣泛應用.如圖表示一個電解池,裝有電解液a;X、Y是兩塊電極板,通過導線與直流電源相連.請回答以下問題:
18.電解原理在化學工業中有廣泛應用.如圖表示一個電解池,裝有電解液a;X、Y是兩塊電極板,通過導線與直流電源相連.請回答以下問題:
(1)若X、Y都是惰性電極,a是飽和NaCl溶液,實驗開始時,同時在兩邊各滴入幾滴酚酞試液,則:
①電解池中X極上的電極反應式是.在X極附近觀察到的現象是.
②Y電極上的電極反應式是,檢驗該電極反應產物的方法是.
(2)如要用電解方法精煉粗銅,電解液a選用CuSO4溶液,則:
①X電極的材料是,電極反應式是.
②Y電極的材料是.組卷:94引用:80難度:0.5


