2020-2021學年北京二十中高一(下)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題。下面各題均有四個選項,其中只有一個符合題意,選出答案后在答題紙上用鉛筆把對應題目的選項字母涂黑涂滿。(共50分。每小題2分)
-
1.某不帶電荷的微粒含有6個電子,7個中子,則它的化學符號可表示為( )
A.13Al B.7N C.6C D.13C 組卷:86引用:4難度:0.7 -
2.砷(As)的原子結構示意圖為
 ,下列關于As的描述不正確的是( )
,下列關于As的描述不正確的是( )A.屬于第四周期元素 B.屬于第ⅤA族元素 C.屬于非金屬元素 D.其非金屬性強于氮 組卷:27引用:4難度:0.8 -
3.下列反應既屬于氧化還原反應,又屬于吸熱反應的是( )
A.鋁片與稀鹽酸的反應 B.碳酸氫鈉粉末與檸檬酸的反應 C.甲烷在氧氣中的燃燒反應 D.灼熱的氧化銅與H2的反應 組卷:44引用:4難度:0.8 -
4.在反應C(s)+CO2(g)=2CO(g)中,能使反應速率加快的是:( )
①增大壓強 ②升高溫度 ③將C粉碎 ④通CO2氣體 ⑤加入足量木炭粉.A.①②③ B.①②④ C.①②③④ D.全部 組卷:50引用:9難度:0.9 -
5.下列的分離方法不正確的是( )
A.用過濾的方法除去食鹽水中的泥沙 B.用蒸餾的方法將酒精和水分離 C.用酒精萃取碘水中的碘 D.用分液法將植物油和水分離 組卷:8引用:2難度:0.5 -
6.X元素最高氧化物對應的水化物為H2XO4,則它對應的氣態氫化物為( )
A.HX B.H2X C.XH4 D.XH3 組卷:161引用:40難度:0.9 -
7.從海帶中提取碘的實驗過程中,涉及到下列操作,其中正確的是( )
A. 
海帶灼燒成灰B. 
過濾得含I-的溶液C. 
放出碘的苯溶液D. 
分離碘并回收苯組卷:140引用:61難度:0.9 -
8.現有a、b、c三種碳氫化合物,其球棍模型如圖,下列有關說法錯誤的是( )
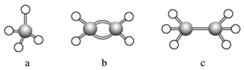
A.分子中所有原子共平面的只有b B.a和c分子結構相似,互為同系物 C.b分子的結構簡式為 
D.c分子中所有的共價鍵都為單鍵 組卷:46引用:4難度:0.9 -
9.下列說法正確的是( )
A.羥基與氫氧根有相同的化學式和電子式 B.乙醇的官能團是-OH,乙醇是含-OH的化合物 C.常溫下,1mol乙醇可與足量的Na反應生成11.2L H2 D. 
已知乙醇的結構式如圖所示,則乙醇催化氧化時斷裂的化學鍵為②③組卷:150引用:6難度:0.7 -
10.一定溫度下,在某恒容的密閉容器中,建立化學平衡:C(s)+H2O(g)?CO(g)+H2(g)。下列敘述不能說明該反應已達到化學平衡狀態的是( )
A.v正(H2O)=v逆(H2O) B.氣體的質量不再發生變化 C.生成nmol CO,同時消耗nmol H2O D.斷裂1mol H-H鍵的同時斷裂2mol H-O鍵 組卷:84引用:2難度:0.5
二、填空題(共50分)
-
 29.近年來甲醇用途日益廣泛,越來越引起商家的關注,工業上甲醇的合成途徑多種多樣。現在實驗室中模擬甲醇合成反應,在2 L密閉容器內,400℃時發生反應:CO(g)+2H2(g)?CH3OH(g),體系中甲醇的物質的量n(CH3OH)隨時間的變化如表:
29.近年來甲醇用途日益廣泛,越來越引起商家的關注,工業上甲醇的合成途徑多種多樣。現在實驗室中模擬甲醇合成反應,在2 L密閉容器內,400℃時發生反應:CO(g)+2H2(g)?CH3OH(g),體系中甲醇的物質的量n(CH3OH)隨時間的變化如表:
(1)圖中表示CH3OH的濃度變化的曲線是時間(s) 0 1 2 3 5 n(CH3OH)(mol) 0 0.009 0.012 0.013 0.013 (填字母)。
(2)用H2表示從0~2s內該反應的平均速率v(H2)=。隨著反應的進行,該反應的速率逐漸減慢的原因是。
(3)該反應是一個放熱反應,說明該反應中破壞1 mol CO和2mol H2的化學鍵吸收的能量形成1mol CH3OH釋放的能量(填“<”、“=”或“>”)。
(4)已知在400℃時,反應CO(g)+2H2(g)?CH3OH(g)生成1 mol CH3OH(g),放出的熱量為116 kJ。計算上述反應達到平衡時放出的熱量Q=kJ。
(5)甲醇燃料電池是目前開發最成功得燃料電池之一,這種燃料電池由甲醇、空氣(氧氣)、KOH(電解質溶液)構成。電池的總反應式為:2CH3OH+3O2+4OH-═2+6H2OCO2-3
則電池放電時通入空氣的電極為(“正”或“負”)極;從電極反應來看,每消耗1mol CH3OH轉移mol電子。組卷:30引用:1難度:0.7 -
30.中國科學院官方微信于2017年3月發表《灰霾專題》,提出灰霾中細顆粒物的成因,部分分析如圖1所示。

(1)根據圖1信息可以看出,下列哪種氣體污染物不是由機動車行駛造成的。
a.SO2 b.NOx c.VOCs d.NH3
(2)機動車大量行駛是污染源之一。汽車發動機廢氣稀燃控制系統主要工作原理如圖2所示;寫出稀燃過程中NO發生的主要反應的方程式。
(3)科學家經過研究發現中國霾呈中性,其主要原因如圖3所示:
請寫出上述轉化過程的離子方程式:。
(4)①在微生物作用下可實現→NH+4→NO-2轉化,稱為硝化過程。在堿性條件下,NO-3被氧氣氧化為NH+4的反應離子方程式為NO-3。
②在一定條件下向廢水中加入甲醇(CH3OH),實現HNO3→→N2轉化,稱為反硝化過程。1 mol HNO3完全轉化為N2,轉移的電子數為NO-2。
(5)煤燃燒排放的煙氣含有SO2和NOx,采用 NaClC2溶液作為吸收劑可同時對煙氣進行脫硫、脫硝。將含有SO2和NOx的煙氣通入盛有 NaClO2溶液的反應器中,反應一段時間后,測得溶液中離子濃度的有關數據如表(其他離子忽略不計)
①上述轉化過程中表現氧化性的物質為離子 Na+ SO2-4NO-3H+ Cl- 濃度(mol?L-1) 5.5×10-3 y 6.0×10-4 2.0×10-4 3.4×10-3 (填化學式)。
②表中y=。組卷:46引用:3難度:0.7


