2022-2023學(xué)年湖北省武漢市重點(diǎn)中學(xué)4G+聯(lián)合體高二(上)期中化學(xué)試卷
發(fā)布:2024/10/2 14:0:2
一、選擇題(本題包括16小題,每題3分,共48分。每小題只有一個選項符合題意。)
-
1.化學(xué)與生產(chǎn)生活密切相關(guān)。下列措施與化學(xué)反應(yīng)速率無關(guān)的有( )
①用鼓風(fēng)機(jī)向爐膛內(nèi)鼓風(fēng)
②化工生產(chǎn)中將礦石粉碎再參與反應(yīng)
③食物存放在冰箱
④糕點(diǎn)包裝內(nèi)放置除氧劑
⑤將固體試劑溶于水配成溶液后反應(yīng)
⑥食品中加入著色劑A.⑥ B.①④ C.④⑤⑥ D.①④⑤⑥ 組卷:9引用:1難度:0.8 -
2.用尿素水解生成的NH3催化還原NO,是柴油機(jī)車輛尾氣凈化的主要方法。反應(yīng)為4NH3(g)+O2(g)+4NO(g)?4N2(g)+6H2O(g),下列說法不正確的是( )
A.上述反應(yīng)ΔS>0 B.上述反應(yīng)平衡常數(shù)K= c4(N2)?c6(H2O)c4(NH3)?c(O2)?c4(NO)C.上述反應(yīng)中消耗17gNH3,轉(zhuǎn)移電子的數(shù)目為3×6.02×1023 D.實(shí)際應(yīng)用中,加入尿素的量越多,柴油機(jī)車輛排放的尾氣對空氣產(chǎn)生的污染越小 組卷:10引用:1難度:0.8 -
3.下列說法正確且不能用勒夏特列原理解釋的是( )
A.濃氨水中加入氫氧化鈉固體產(chǎn)生刺激性氣味的氣體 B.對NO2(g)+CO(g)?CO2(g)+NO(g)平衡體系加壓,氣體顏色變深 C.用飽和食鹽水除去Cl2中的HCl,可減少Cl2的損失 D.其他條件不變,加壓,SO2氣體在水中溶解度增大 組卷:8引用:1難度:0.8 -
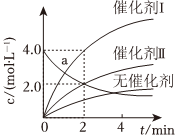 4.在相同條件下研究催化劑Ⅰ、Ⅱ?qū)Ψ磻?yīng)X→2Y的影響,各物質(zhì)濃度c隨反應(yīng)時間t的變化的部分曲線如圖,下列說法正確的是( )
4.在相同條件下研究催化劑Ⅰ、Ⅱ?qū)Ψ磻?yīng)X→2Y的影響,各物質(zhì)濃度c隨反應(yīng)時間t的變化的部分曲線如圖,下列說法正確的是( )A.對于不能自發(fā)發(fā)生的反應(yīng),可尋找高效催化劑使其發(fā)生 B.與催化劑Ⅰ相比,Ⅱ使反應(yīng)活化能更低 C.a(chǎn)曲線表示使用催化劑Ⅰ時X的濃度隨t的變化 D.使用催化劑時,能提高產(chǎn)物的產(chǎn)率 組卷:3引用:2難度:0.7 -
5.下列事實(shí)能說明影響化學(xué)反應(yīng)速率的決定性因素是反應(yīng)物本身性質(zhì)的是( )
A.鎂片與冷水難反應(yīng),鈉在冷水中劇烈反應(yīng) B.Cu與濃硝酸反應(yīng)比與稀硝酸反應(yīng)快 C.N2與O2在常溫常壓下不反應(yīng),放電時可反應(yīng) D.H2O2在加入MnO2后,分解速率加快 組卷:11引用:1難度:0.5 -
6.下列有關(guān)說法正確的是( )
A.恒溫恒壓下,向2NO2(g)?N2O4(g)平衡體系充入N2,正逆反應(yīng)速率都不變 B.通過光輻射、超聲波、高速研磨等,也有可能改變反應(yīng)速率 C.升高溫度和增大壓強(qiáng)都可以提高反應(yīng)體系內(nèi)活化分子百分?jǐn)?shù) D.加入催化劑,不能改變活化分子百分?jǐn)?shù) 組卷:10引用:1難度:0.8
第Ⅱ卷(非選擇題共55分)
-
18.目前,常利用催化技術(shù)將汽車尾氣中的NO和CO進(jìn)行下列轉(zhuǎn)化:2NO+2CO?2CO2+N2。為研究如何增大該化學(xué)反應(yīng)的速率,某課題組進(jìn)行了以下實(shí)驗探究。
【提出問題】在其他條件不變的情況下,溫度或催化劑的比表面積(單位質(zhì)量的物質(zhì)所具有的總面積)如何影響汽車尾氣的轉(zhuǎn)化速率?
【查閱資料】使用等質(zhì)量的同種催化劑,催化劑的比表面積對催化效率有影響。
【實(shí)驗設(shè)計】實(shí)驗數(shù)據(jù)如表所示:
【圖像分析與結(jié)論】三組實(shí)驗中CO的濃度隨時間的變化如圖1所示(曲線Ⅰ表示實(shí)驗Ⅰ)。編號 t/℃ c(NO)/(mol?L-1) c(CO)/(mol?L-1) 催化劑的比表面積/(m2?g-1) Ⅰ 280 6.50×10-3 4.00×10-3 80.0 Ⅱ t c1 4.00×10-3 120 Ⅲ 360 c2 4.00×10-3 80.0 
(1)實(shí)驗數(shù)據(jù)表格中,t=;c2=。
(2)第I組實(shí)驗中,從反應(yīng)開始到達(dá)到平衡用時3min,用N2表示該反應(yīng)在此段時間內(nèi)的反應(yīng)速率為。
(3)要得出催化劑的比表面積對催化效率的影響,應(yīng)比較曲線和曲線(填“I”、“a”或“b”)。
(4)從影響反應(yīng)速率的角度分析,由曲線Ⅰ和a可得出的結(jié)論是。
【拓展探究】該課題組進(jìn)一步探究催化劑對CO、NO轉(zhuǎn)化的影響。
(5)將NO和CO以一定的流速通過兩種不同的催化劑進(jìn)行反應(yīng),相同時間內(nèi)測量逸出氣體中NO含量,從而確定尾氣脫氮率(脫氮率即NO的轉(zhuǎn)化率),結(jié)果如圖2所示。
①若低于200℃,圖2中曲線X脫氮率隨溫度升高而變化不大的主要原因為;
②m點(diǎn)(填“是”或“不是”)對應(yīng)溫度下的平衡脫氮率,說明你判斷的理由。組卷:5引用:1難度:0.6 -
19.氫氣是重要的工業(yè)原料,同時也是一種理想的二次能源。“制氫”“儲氫”“用氫”一直都是能源研究的重點(diǎn)。
(1)煤的氣化是一種重要的制氫途徑。煤的氣化發(fā)生反應(yīng)如下
Ⅰ.C(s)+H2O(g)?CO(g)+H2(g)
Ⅱ.CO(g)+H2O(g)?CO2(g)+H2(g)
在一定溫度下,向體積固定的密閉容器中加入足量的C(s)和1mol H2O(g),起始壓強(qiáng)為0.2MPa時,發(fā)生上述反應(yīng)生成水煤氣。反應(yīng)達(dá)到平衡狀態(tài)時,H2O(g)的轉(zhuǎn)化率為50%,CO的物質(zhì)的量為0.1mol。該溫度下,反應(yīng)Ⅱ的平衡常數(shù)K=。
(2)鑭鎳合金是一種良好的儲氫材料。向體積恒定的密閉容器中充入氫氣發(fā)生如下反應(yīng):LaNi5(s)+3H2(g)?LaNi5H6(s)。H2的平衡轉(zhuǎn)化率與其初始充入的物質(zhì)的量(n)、反應(yīng)溫度(T)的關(guān)系如圖a所示。
①該反應(yīng)平衡常數(shù)的大小關(guān)系K(T1)K(T2)(填“>”“>”或“=”),理由是。
②圖中,若不同溫度下氫氣平衡轉(zhuǎn)化率相等,則氫氣初始充入量由大到小的順序是。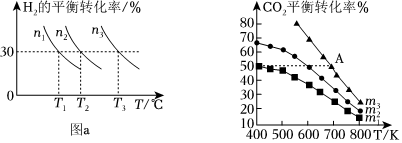
(3)工業(yè)用二氧化碳加氫可合成乙醇:2CO2(g)+6H2(g)?C2H5OH(g)+3H2O(g)。保持壓強(qiáng)為5MPa,向密閉容器中投入一定量CO2和H2發(fā)生上述反應(yīng),CO2的平衡轉(zhuǎn)化率與溫度、投料比m(起始加入的H2與CO2的物質(zhì)的量之比)的關(guān)系如圖b所示。
①投料比m1、m2與m3由大到小的順序為。
②若投料比m=1,一定溫度下發(fā)生反應(yīng),在建立平衡過程中:
ⅰ.CO2的體積分?jǐn)?shù)是否變化(填“是”或“否”)。
ⅱ.下列說法不能作為反應(yīng)是否達(dá)平衡標(biāo)志的是(填標(biāo)號)。
a.容器內(nèi)氣體密度不再變化
b.容器內(nèi)氣體平均相對分子質(zhì)量不再變化
c.CO2的體積分?jǐn)?shù)不再變化
d.容器內(nèi)H2與CO2的物質(zhì)的量之比不再變化
e.斷裂3NA個H—H鍵的同時生成1.5NA個水分子
③若m3=3,其他條件不變,A點(diǎn)對應(yīng)起始反應(yīng)物置于某恒容密閉容器中,則平衡時CO2的轉(zhuǎn)化率50%(填“>”“=”或“<”)。組卷:8引用:1難度:0.5


