魯科版(2019)必修第二冊《2.2.1 化學反應中能量變化的本質及轉化形式》2020年同步練習卷(1)
發布:2024/12/30 11:0:3
-
1.下列反應中,屬于放熱反應的是( )
①煅燒石灰石②燃燒木炭取暖③炸藥爆炸④酸與堿的中和反應⑤碳與水蒸氣制水煤氣⑥食物因氧化而腐敗A.①②④⑤ B.②④⑤⑥ C.②③④⑥ D.全部 組卷:33引用:2難度:0.7 -
2.在下列反應中,反應物的總能量低于生成物的總能量的是( )
A.2H2+O2 2H2O點燃B.CaCO3 CaO+CO2↑煅燒C.CaO+CO2=CaCO3 D.C2H5OH+3O2 2CO2+3H2O點燃組卷:33引用:4難度:0.7 -
3.已知反應物的總能量高于產物的總能量,則反應是( )
A.放熱反應 B.吸熱反應 C.有催化劑作用 D.無法判斷 組卷:79引用:10難度:0.9 -
4.下列過程放出熱量的是( )
A.斷裂化學鍵 B.水的分解 C.總能量生成物高于反應物的反應 D.濃硫酸稀釋 組卷:34引用:2難度:0.7 -
5.已知斷開1molH-H鍵吸收的能量為436KJ,形成1molN-H鍵放出的能量為391KJ,根據化學方程式N2+3H2
2NH3,反應完1molN2放出的能量為92.4KJ,則斷開1molN=N鍵吸收的能量是( )催化劑高溫,高壓A.431KJ B.649KJ C.869KJ D.945.6KJ 組卷:94引用:8難度:0.5
-
15.H2+Cl2═2HCl的化學反應可用如圖表示。
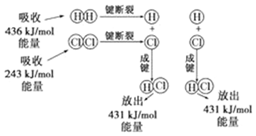
請回答下列有關問題:
(1)反應物斷鍵吸收的總能量為。
(2)生成物成鍵放出的總能量為。
(3)1mol H2和1mol Cl2反應生成2mol HCl是(填“吸收”或“放出”)能量的反應,其能量值為。
(4)反應物總能量(填“>”或“<”)生成物總能量。組卷:11引用:1難度:0.7 -
16.某同學設計如下三個實驗方案以探究某反應是放熱反應還是吸熱反應:
方案一:如圖1,在小燒杯里放一些除去氧化鋁保護膜的鋁片,然后向燒杯里加入10mL 2mol?L-1稀硫酸,再插
入一支溫度計,溫度計的溫度由20℃逐漸升至75℃,隨后,溫度逐漸下降至30℃,最終停留在20℃.
方案二:如圖2,在燒杯底部用熔融的蠟燭粘一塊小木片,在燒杯里加入10mL 2mol?L-1硫酸溶液,再向其中加
入氫氧化鈉溶液,片刻后提起燒杯,發現小木片脫落下來.
方案三:如圖3,甲試管中發生某化學反應,實驗前U形管紅墨水液面相平,在化學反應過程中,通過U形管兩側紅墨水液面高低判斷某反應是吸熱反應還是放熱反應.
根據上述實驗回答相關問題:序號 甲試管里發生反應的物質 U形管里紅墨水液面 ① 氧化鈣與水 左低右高 ② 氫氧化鋇晶體與氯化銨晶體(充分攪拌) ? ③ 鋁片與燒堿溶液 左低右高 ④ 銅與濃硝酸 左低右高
(1)鋁片與稀硫酸的反應是(填“吸熱”或“放熱”)反應,寫 出該反應的離子方程式:.
(2)方案一中,溫度升至最大值后又下降的原因是.
(3)方案二中,小木片脫落的原因是,由此得出的結論是.
(4)方案三中,如果甲試管里發生的反應是放熱反應,則U形管里紅墨水液面:左邊(填“高于”“低于”或“等于”)右邊.
(5)由方案三的現象得出結論:①③④組物質發生的反應都是(填“吸熱”或“放熱”)反應,如果放置較長時間,可觀察到U形管里的現象是.
(6)方案三實驗②的U形管中的現象為,說明反應物的總能量(填“大于”“小于”或“等于”)生成物的總能量.組卷:68引用:4難度:0.3


