2022-2023學年廣東省廣州市白云中學高一(下)期中化學試卷
發布:2024/5/15 8:0:8
一、選擇題(1-10題每題2分,11-16每題4分,共44分。)
-
1.十八大以來,我國科學技術迅猛發展。下列設備工作時,將化學能轉化為電能的是( )




A.太陽能集熱器 B.風力發電機 C.偏二甲肼燃燒 D.鋰離子電池 A.A B.B C.C D.D 組卷:58引用:6難度:0.6 -
2.硅及其化合物與科學、技術,社會,環境密切相關。下列有關說法不正確的是( )
A.單質硅是將太陽能轉變為電能的常用材料 B.硅主要以單質形式存在于自然界中 C.水晶、石英、瑪瑙等的主要成分是SiO2而不是硅酸鹽 D.傳統無機非金屬材料陶瓷、水泥、玻璃的主要成分是硅酸鹽 組卷:72引用:4難度:0.6 -
3.下列反應中,酸體現還原性的是( )
A.MnO2與濃鹽酸共熱制Cl2 B.Na2SO3與濃硫酸共熱制SO2 C.Zn與稀硫酸反應制H2 D.Cu與稀硝酸反應制備NO 組卷:85引用:7難度:0.7 -
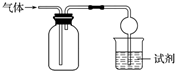 4.如圖所示裝置可用于收集SO2并驗證其某些化學性質,下列說法正確的是( )
4.如圖所示裝置可用于收集SO2并驗證其某些化學性質,下列說法正確的是( ) 選項 試劑 現象 結論 A 酸性KMnO4溶液 溶液褪色 SO2有氧化性 B 品紅溶液 溶液褪色 SO2有漂白性 C NaOH溶液 無明顯現象 SO2與NaOH溶液不反應 D 溴水 溶液褪色 SO2有漂白性 A.A B.B C.C D.D 組卷:88引用:3難度:0.7 -
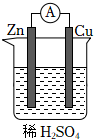 5.關于如圖所示的原電池,下列說法正確的是( )
5.關于如圖所示的原電池,下列說法正確的是( )A.該裝置能將電能轉化為化學能 B.鋅片上發生還原反應 C.電子由鋅片通過導線流向銅片 D.銅片上發生的反應為Cu2++2e-═Cu 組卷:79引用:6難度:0.8 -
6.除去粗鹽中的雜質MgCl2、CaCl2和Na2SO4,過程如圖:

下列有關說法中,不正確的是( )A.試劑①、②、③分別是NaOH、Na2CO3、BaCl2 B.除去Ca2+的主要反應:Ca2++ =CaCO3↓CO2-3C.檢驗 是否除凈的方法:取上層清液加BaCl2溶液,觀察是否產生沉淀SO2-4D.加稀鹽酸調節pH后,采用蒸發結晶的方法得到NaCl固體 組卷:71引用:5難度:0.7
一、選擇題(1-10題每題2分,11-16每題4分,共44分。)
-
19.Ⅰ.在2L的恒容密閉容器中充入1molCO和2molH2,一定條件下發生反應:CO(g)+2H2(g)?CH3OH(g),測得CO和CH3OH(g)的物質的量變化如圖1所示,反應過程中的能量變化如圖2所示。
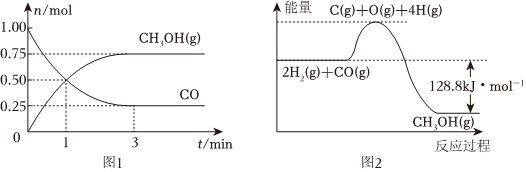
(1)從反應開始至達到平衡,以H2表示反應的平均反應速率v(H2)=。
(2)下列措施能增大反應速率的是(填字母)。
A.升高溫度
B.降低壓強
C.減小CH3OH的濃度
D.加入合適的催化劑
(3)平衡時CO的轉化率為。
(4)已知斷開1molCO(g)和2molH2(g)中的化學鍵需要吸收的能量為1924kJ,則斷開1molCH3OH(g)中的所有化學鍵所需要吸收kJ的能量。
Ⅱ.燃料電池是利用燃料與氧乞反應從而將化學能轉化為電能的裝置,以葡萄糖為燃料的微生物燃料電池結構示意圖如圖所示。注:電解質為稀硫酸;質子交換膜只通過H+。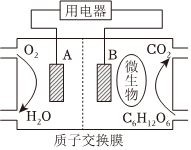
葡萄糖與氧氣反應的化學方程式為C6H12O6+6O2=6CO2+6H2O。
(5)B為生物燃料電池的(填“正”或“負”)極。
(6)正極反應式為。
(7)在電池反應中,每消耗1mol氧氣,理論上生成標準狀況下二氧化碳的體積是。組卷:49引用:1難度:0.6 -
20.在化學反應的研究和實際應用中,人們除了選擇合適的化學反應以實現新期特的物質轉化或能量轉化,還要關注化學反應進行的快慢和程度,以提高生產效率。
(1)控制條件,讓反應在恒容密閉容器中進行如下反應:2NO(g)+2CO(g)?N2(g)+2CO2(g)。用傳感器測得不同時間NO和CO的濃度如表。
前2s內的平均反應速率v(N2)=時間/s 0 1 2 3 4 5 c(NO)/(10-4mol/L) 10.0 4.50 2.50 1.50 1.00 1.00 c(CO)/(10-3mol/L) 3.60 3.05 2.85 2.75 2.70 2.70 ,從表格看,已達化學平衡的時間段為:。
(2)如圖是在一定溫度下,某固定容積的密閉容器中充入一定量的NO2氣體后,發生反應2NO2?N2O4,已知NO2是紅棕色氣體,N2O4是無色氣體。反應速率(v)與時間(t)的關系曲線。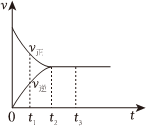
下列敘述正確的是。
a.t1時,反應未達到平衡,NO2濃度在減小
b.t2時,反應達到平衡,反應不再進行
c.t2~t3各物質濃度不再變化
d.t2~t3各物質濃度相等
e.0~t2,N2O4濃度增大
f.反應過程中氣體的顏色不變
(3)在壓強為0.1MPa條件下,amolCO與3amolH2的混合氣體在催化劑作用下能自發放熱反應生成甲醇:CO(g)+2H2(g)?CH3OH(l)。為了尋得合成甲醇的適宜溫度與壓強,某同學設計了三組實驗,部分實驗條件已經填在下面的實驗設計表中。表中剩余的實驗數據:n=,m=。
(4)比較相同濃度的Na2S2O3溶液和不同濃度的H2SO4溶液反應的反應快慢可通過測定實驗編號 T(℃) n(CO):n(H2) P(MPa) ① 180 2:3 0.1 ② n 2:3 5 ③ 350 m 5 來實現。
(5)在四個不同的容器中,在不同的條件下進行合成氨反應:N2+3H2?2NH3。根據在相同時間內測定的結果判斷,生成氨氣的反應速率由大到小排列。
A.v(H2)=0.6mol/(L?min)
B.v(N2)=0.3mol/(L?min)
C.v(NH3)=0.15mol/(L?min)
D.v(H2)=0.3mol/(L?min)組卷:37引用:1難度:0.6


