2022-2023學年天津中學高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、單選題(本大題共20小題,共60分)
-
1.在25℃時,用蒸餾水稀釋1mol/L氨水至0.01 mol/L,隨溶液的稀釋,下列各項中始終保持增大趨勢的是( )
A. c(OH-)c(NH3?H2O)B. c(NH4+)c(OH-)C. c(NH3?H2O)c(NH4+)D.c(OH-) 組卷:339引用:16難度:0.7 -
2.室溫條件下,用0.1000mol/L的NaOH溶液分別滴定HX、HY、HZ的溶液,三種酸溶液的體積均為20.00mL,濃度均為0.1000mol/L,滴定曲線如圖所示。下列敘述正確的是( )
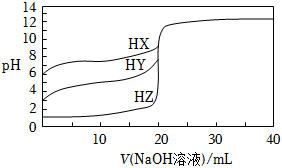
A.酸性強弱:HX>HY>HZ B.滴定這三種酸時,均可選擇酚酞做指示劑 C.電離常數Ka(HY)=10-6 D.HZ的電離方程式為HZ?H++Z- 組卷:44引用:2難度:0.7 -
 3.使用如圖裝置(攪拌裝置略)探究溶液離子濃度變化,燈光變化不可能出現“亮→暗(或滅)→亮”現象的是( )
3.使用如圖裝置(攪拌裝置略)探究溶液離子濃度變化,燈光變化不可能出現“亮→暗(或滅)→亮”現象的是( )A B C D 試劑a CuSO4 NH4HCO3 CH3COOH H2SO4 試劑b Ba(OH)2 Ca(OH)2 NH3?H2O Ba(OH)2 A.A B.B C.C D.D 組卷:53引用:2難度:0.4 -
4.實驗室用標準鹽酸溶液滴定某NaOH溶液。用甲基橙作指示劑。下列操作中可能使測定結果偏低的是( )
A.酸式滴定管在裝液前未用標準酸溶液潤洗2~3次 B.開始實驗時酸式滴定管尖嘴部分有氣泡,在滴定過程中氣泡消失 C.盛NaOH溶液的錐形瓶滴定前用NaOH溶液潤洗2~3次 D.滴定前平視讀數,滴定后俯視讀數 組卷:80引用:7難度:0.7 -
5.下列溶液中因水的電離被促進而導致溶液呈酸性的是( )
A.NaHSO4溶液 B.Na2SO3溶液 C.KNO3溶液 D.KAl(SO4)2溶液 組卷:10引用:2難度:0.7 -
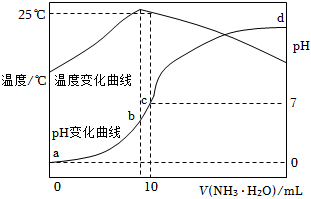 6.在某溫度時,將n mol?L-1氨水滴入10mL 1.0mol?L-1鹽酸中,溶液pH和溫度隨加入氨水體積變化曲線如圖所示。下列有關說法正確的是( )
6.在某溫度時,將n mol?L-1氨水滴入10mL 1.0mol?L-1鹽酸中,溶液pH和溫度隨加入氨水體積變化曲線如圖所示。下列有關說法正確的是( )A.a點KW=1.0×10-14 B.b點:c(NH4+)>c(Cl-)>c(H+)>c(OH-) C.25℃時,NH4Cl水解常數為(n-1)×10-7(用n表示) D.d點水的電離程度最大 組卷:153引用:9難度:0.6 -
7.有四種物質的量濃度相等、且都由一價陽離子A+和B+及一價陰離子X-和Y-組成的鹽溶液.據測定常溫下AX和BY溶液的pH=7,AY溶液的pH>7,BX溶液的pH<7,由此判斷不水解的鹽是( )
A.BX B.AX C.AY D.BY 組卷:233引用:15難度:0.7
二、簡答題(共40分)
-
22.在T℃條件下,向1L固定體積的密閉容器M中加入2mol X和1mol Y,發生如下反應:2X(g)+Y(g)?a Z(g)+W(g)△H=-Q kJ?mol-1(Q>0)
當反應達到平衡后,反應放出的熱量為Q1kJ,物質X的轉化率為α;若平衡后再升高溫度,混合氣體的平均相對分子質量減小,則
(1)化學計量數a的值為;此反應的逆反應△S0 (填<,>,﹦)。
(2)下列說法中能說明該反應達到了化學平衡狀態的是。
A、容器內壓強一定 B、v(X)正=2v (Y)逆
C、容器內Z分子數一定 D、容器內氣體的質量一定
E、容器內氣體的密度一定 F:X、Y、Z、W的濃度之比為2:1:a:1
(3)、維持溫度不變,若起始時向該容器中加入的物質的量如下列各項,則反應達到平衡后(稀有氣體不參與反應),與之是等效平衡的是。
A.2mol X、1mol Y、1mol Ar B.a mol Z、1mol W
C.1molX、0.5mol Y、0.5a mol Z、0.5mol W D.2mol X、1mol Y、1mol Z
(4)、維持溫度不變,若起始時向容器中加入4mol X和6mol Y,若達平衡時容器內的壓強減小了15%,則反應中放出的熱量為kJ。
(5)已知:該反應的平衡常數隨溫度的變化如下表:
試回答下列問題:溫度/℃ 150 200 250 300 350 平衡常數K 9.94 5.2 1 0.5 0.21
若在某溫度下,2mol X和1mol Y在該容器中反應達平衡,X的平衡轉化率為50%,則該溫度為℃。組卷:109引用:2難度:0.4 -
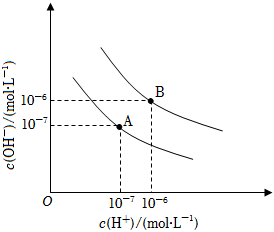 23.已知水在25℃和95℃時,其電離平衡曲線如圖所示:
23.已知水在25℃和95℃時,其電離平衡曲線如圖所示:
(1)25℃時水的電離平衡曲線應為(填“A”或“B”)。
(2)25℃時,將pH=9的NaOH溶液與pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,則pH=9的NaOH溶液與pH=4的H2SO4溶液的體積之比為。
(3)95℃時,若100體積pH1=a的某強酸與1體積pH2=b的某強堿混合后溶液呈中性,則混合前,該強酸的pH1與強堿的pH2之間應滿足的關系是。
(4)明礬[化學式為KAl(SO4)2?12H2O]溶液呈性(填“酸”“堿”或“中”),原因是(用離子方程式表示)。在實驗室配制Na2S溶液時,常滴加幾滴NaOH溶液,試說明原因:。(用離子方程式表示)組卷:24引用:1難度:0.7


