2012-2013學年福建省南平市建甌二中高二(上)模塊檢測化學試卷(反應原理)
發(fā)布:2024/4/20 14:35:0
一、選擇題
-
1.在0.1mol/L的氨水中存在 NH3?H2O?NH4++OH-的電離平衡,下列措施都能使 該平衡向右移動的一組是( )
①加入少量HCl;②加入固體NaOH;③加水;④通入氨氣;⑤加熱升高溫度;⑥加入NH4NO3。A.①③④⑤ B.①③④⑤⑥ C.②③④⑤ D.①③④⑥ 組卷:9引用:2難度:0.7 -
2.在一定條件下發(fā)生下列反應,其中屬于鹽類水解反應的是( )
A. +2H2O═NH3?H2O+H3O+NH+4B. +H2O═H3O++HCO-3CO2-3C.HS-+H+═H2S D.Cl2+H2O═H++Cl-+HClO 組卷:57引用:15難度:0.7 -
3.下列操作對滴定結(jié)果無影響的是( )
A.盛待測液的錐形瓶先用待測液潤洗 B.滴定管尖嘴部分有氣泡,滴定結(jié)束后氣泡消失 C.滴定管在滴定前未將液面刻度調(diào)整至0 D.達到滴定終點時俯視讀取滴定管內(nèi)液體體積 組卷:3引用:1難度:0.6 -
4.pH=a的某電解質(zhì)溶液中,插入兩支惰性電極通直流電一段時間后,溶液的pH>a,則該電解質(zhì)可能是( )
A.Na2SO4 B.H2SO4 C.AgNO3 D.NaOH 組卷:162引用:82難度:0.7 -
5.有人欲配制下列含有四種不同陰、陽離子的溶液,其中能配制成功的是( )
A.Fe2+、OH-、H+、Cl-、 NO-3B.Ca2+、H+、Cl-、 CO2-3C.Mg2+、Al3+、Cl-、 SO2-4D.Na+、Ba2+、 、NO-3SO2-4組卷:5引用:2難度:0.9 -
6.已知:H+(aq)+OH-(aq)═H2O(l);△H=-57.3kJ?mol-1.現(xiàn)將一定量的稀鹽酸、濃硫酸、稀醋酸分別和1L 1mol?L-1的NaOH溶液恰好完全反應,其反應熱分別為△H1、△H2、△H3,則△H1、△H2和△H3的大小關(guān)系為( )
A.△H1═△H2>△H3 B.△H3>△H2>△H1 C.△H3>△H1>△H2 D.△H2>△H1>△H3 組卷:86引用:13難度:0.9
二、非選擇題
-
17.煤化工中常需研究不同溫度下平衡常數(shù)、投料比及熱值等問題
已知:CO(g)+H2O(g)?H2(g)+CO2(g)的平衡常數(shù)隨溫度變化如下表:
試回答下列問題溫度/℃ 400 500 800 平衡常數(shù)Kc 9.94 9 1
(1)上述正向反應是:反應(選填:放熱、吸熱).
(2)在800℃發(fā)生上述反應,以表中的物質(zhì)的量投入恒容反應器,其中向正反應方向移動的有(選填A、B、C、D、E)
(3)已知在一定溫度下:C(s)+CO2(g)?2CO(g)平衡常數(shù)K;C(s)+H2O(g)?CO(g)+H2(g) 平衡常數(shù)K1;CO(g)+H2O(g)?H2(g)+CO2(g) 平衡常數(shù)K2,則K、K1、K2之間的關(guān)系是:A B C D E n(CO2) 3 1 0 1 1 n(H2) 2 1 0 1 2 n(CO) 1 2 3 0.5 3 n(H2O) 5 2 3 2 1
(4)在VL密閉容器中通入10molCO和10mol水蒸氣,在T℃達到平衡,然后急速除去水蒸氣(除水蒸氣時各物質(zhì)的物質(zhì)的量不變),將混合氣體燃燒,測得放出的熱量為2842kJ(已知CO燃燒熱為283kJ/mol,H2燃燒熱為286kJ/mol),則T℃平衡常數(shù)K=.組卷:10引用:2難度:0.5 -
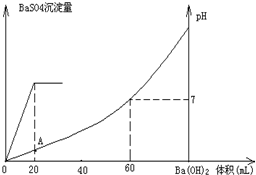 18.常溫下,向20mL硫酸和鹽酸混合溶液中加入0.05mol/L的Ba(OH)2溶液時,生成BaSO4沉淀量及溶液pH發(fā)生如圖所示的變化.
18.常溫下,向20mL硫酸和鹽酸混合溶液中加入0.05mol/L的Ba(OH)2溶液時,生成BaSO4沉淀量及溶液pH發(fā)生如圖所示的變化.
(1)開始時混合溶液中硫酸和鹽酸的物質(zhì)的量濃度各是多少?
(2)在A點溶液的pH是多少?組卷:25引用:7難度:0.3


