2019-2020學年江蘇省鎮江中學高一(上)期中化學試卷
發布:2024/4/20 14:35:0
一.單選題(本題包括23小題,每小題3分,共69分,每小題只有一個正確選項符合題意)
-
1.13C—NMR(核磁共振)、15N—NMR可用于測定蛋白質、核酸等生物大分子的空間結構,Kurt Wu thrich等人為此獲得2002年諾貝爾化學獎。下面有關13C、15N敘述正確的是( )
A.13C與15N有相同的中子數 B.13C與C60互為同素異形體 C.15N與14N互為同位素 D.15N的核外電子數與中子數相同 組卷:232引用:84難度:0.9 -
2.Na2CO3俗名純堿,下面是對純堿采用不同的分類法進行分類,不正確的是( )
A.Na2CO3是堿 B.Na2CO3是鹽 C.Na2CO3是鈉鹽 D.Na2CO3是碳酸鹽 組卷:672引用:136難度:0.9 -
3.目前市場上有一種專門為嬰幼兒設計的電解質飲料,適合在嬰幼兒感冒、發燒時快速補充體內流失的電解質成分.下列物質可用作該飲料中的電解質的是( )
A.Fe B.葡萄糖 C.MgSO4 D.CO2 組卷:231引用:22難度:0.7 -
4.當光束通過雞蛋清水溶液時,從側面觀察到一條光亮的“通路”,說明雞蛋清水溶液屬于( )
A.溶液 B.懸濁液 C.乳濁液 D.膠體 組卷:108引用:49難度:0.9 -
5.設NA為阿伏加德羅常數的值,下列敘述正確的是( )
A.1.8g H2O含有的電子數為0.1NA B.標準狀況下,22g CO2與11.2L H2O含有相同的原子數 C.常溫常壓下,48g O2與O3的混合氣體中含有的原子總數為3NA D.1mol?L-1的蔗糖水溶液中含蔗糖分子的數目為NA 組卷:229引用:4難度:0.3 -
6.將一小塊金屬鈉投入下列溶液中,既能產生氣體又會出現沉淀的是( )
A.稀硫酸 B.稀氯化鈉溶液 C.硫酸銅溶液 D.氯化銨溶液 組卷:6引用:1難度:0.6 -
7.為檢驗溶液里的某種離子,進行下列實驗,其中結論正確的是( )
A.溶液中加AgNO3溶液有白色沉淀生成,再加入稀鹽酸沉淀不溶解,溶液一定含Cl- B.溶液中加入BaCl2溶液有白色沉淀,再加入稀鹽酸沉淀不溶解,則溶液中含SO42- C.溶液中加入NaOH溶液,加熱,產生使濕潤紅色石蕊試紙變藍的氣體,溶液中一定NH4+ D.溶液中加入稀HCl,產生使澄清石灰水變渾濁的無色氣體,則溶液中一定含CO32- 組卷:6引用:1難度:0.5 -
8.下列各組溶液中離子,能在溶液中大量共存且溶液為澄清透明的是( )
A.K+、Cu2+、NO3-、OH- B.H+、Na+、Cl-、HCO3- C.Ag+、Na+、Cl-、K+ D.Fe3+、K+、NO3-、SO42- 組卷:10引用:2難度:0.7
二、填空題(共31分)
-
25.實驗室常用二氧化錳和濃鹽酸共熱的方法制取氯氣。根據要求回答下列問題。
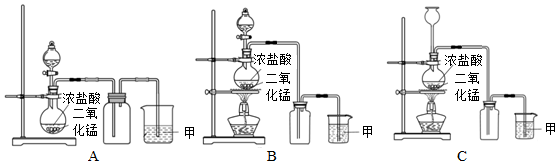
(1)A、B、C三套裝置中,應選用的裝置是(選填“A”、“B”、“C”);
(2)寫出制取氯氣的化學方程式。
(3)為了防止氯氣污染環境,圖中溶液甲中發生的化學反應方程式。
(4)由于氯氣貯存運輸不方便,工業上常將氯氣轉化為漂白粉,在空氣中漂白粉長期存放會變質而失效的原理是(用化學方程式說明)。
(5)實驗室也可用KMnO4固體和濃鹽酸反應制取氯氣,反應方程式如下:2 KMnO4+16HCl(濃)=2KCl+2MnCl2+8H2O+5Cl2↑,請用雙鍵橋標出電子轉移的方向和數目:;若反應中有0.5mol電子轉移,被氧化HCl的物質的量為。
(6)此實驗所得漂白粉的有效成分偏低,該學生經分析并查閱資料發現,主要原因是在U形管中還存在副反應,溫度較高時氯氣與消石灰反應生成Ca(ClO3)2,請寫出該副反應的化學方程式。組卷:70引用:1難度:0.6 -
26.氯酸鎂[Mg(ClO3)2]常用作催熟劑、除草劑等,制備少量Mg(ClO3)2?6H2O的流程如下:
已知:①鹵塊主要成分為MgCl2?6H2O,含有較多的MgSO4、MgCO3、FeCl2等雜質.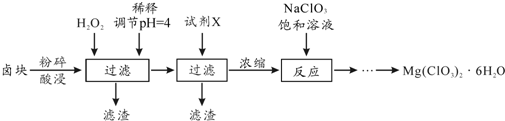
②四種化合物的溶解度(S)隨溫度(T)變化曲線如圖所示.
(1)過濾的主要玻璃儀器除燒杯、漏斗外,還需要.
(2)加H2O2調節pH后過濾所得濾渣的主要成分為.
(3)試劑X的滴加順序為.
a.BaCl2溶液,Na2CO3溶液,過濾后加適量鹽酸
b.Na2CO3溶液,BaCl2溶液,過濾后加適量鹽酸
c.以上兩種順序都可
(4)加入NaClO3飽和溶液后發生反應的化學方程式為,再進一步制取Mg(ClO3)2?6H2O的實驗步驟依次為:①蒸發結晶;②趁熱過濾;③;④過濾、洗滌.
(5)產品中Mg(ClO3)2?6H2O含量的測定:
步驟1:準確稱量4.20g產品配成100mL溶液.
步驟2:取10.00mL于錐形瓶中,加入30.00mL 0.200mol?L-1的Na2S2O3溶液.
步驟3:用0.100mol?L-1碘液滴定剩余的Na2S2O3,此過程中反應的離子方程式為:2S2O32-+I2═S4O62-+2I-
步驟4:將步驟2、3重復兩次,平均消耗標準碘液20.00mL.
①步驟2中,硫元素被氧化至最高價態,試寫出該反應的離子方程式.
②產品中Mg(ClO3)2?6H2O的質量分數為.組卷:109引用:3難度:0.5


