2022-2023學年河北省衡水市深州中學高三(上)第二次月考化學試卷
發布:2024/11/29 3:0:2
一、單項選擇題(共9題,每題3分,共27分。每題只有一個正確選項)
-
1.如圖所示我國科技成果所涉及物質的應用中,具體操作或過程不涉及化學變化的是( )
A. 
利用雷達探測巡視表面土壤厚度、冰層結構B. 
利用模擬月壤研究從鈦鐵礦(FeTiO3)中提取鐵C. 
利用陽光將廢二氧化碳轉化為有用物質D. 
利用深海鋰電池為“奮斗者”號控制系統提供電能組卷:23引用:3難度:0.8 -
2.下列由NaCl的實驗事實得出的結論不正確的是( )
選項 A B C D
實驗事實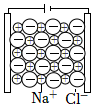
NaCl固體不導電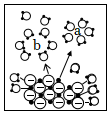
NaCl溶于水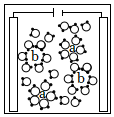
NaCl溶液通電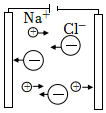
熔融NaCl能導電結論 NaCl不是電解質 NaCl 在水中發生電離:NaCl═Na++Cl- a離子是Na+,通電后a、b離子定向移動 NaCl熔融時能電離出自由移動的離子 A.A B.B C.C D.D 組卷:102引用:4難度:0.8 -
3.設NA為阿伏加德羅常數的值,下列說法正確的是( )
A.過氧化鈉與水反應時,生成0.1mol氧氣轉移的電子數為0.1NA B.3.2gO2和O3的混合氣體中含有的氧原子數目為0.2NA C.標準狀況下,22.4LCl2溶于水配成500mL新制氯水,氯水中Cl-數為2NA D.0.12molMnO2與足量0.1mol/L的鹽酸反應生成Cl2的分子數為0.12NA 組卷:33引用:1難度:0.7 -
4.為探究氯氣的某些性質,設計如圖裝置。下列有關反應的離子方程式不正確的是( )
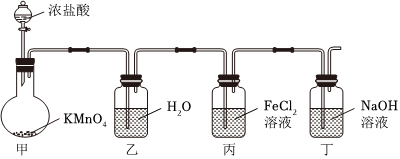
A.甲產生黃綠色氣體:2 +10Cl-+16H+═2Mn2++5Cl2↑+8H2OMnO-4B.乙可制得飽和氯水:Cl2+H2O?2H++Cl-+ClO- C.丙中溶液顯棕黃色:Cl2+2Fe2+═2Cl-+2Fe3+ D.丁可用于處理尾氣:Cl2+2OH-═H2O+Cl-+ClO- 組卷:23引用:4難度:0.6 -
5.下列實驗操作對應的現象不符合事實的是( )
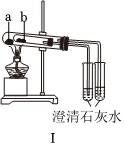
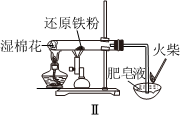
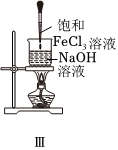
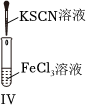
A.裝置Ⅰ中a盛放碳酸鈉,b盛放碳酸氫鈉,可對比二者的熱穩定性 B.裝置Ⅱ用于檢驗鐵粉與水蒸氣反應產生的氫氣 C.裝置Ⅲ用于制備氫氧化鐵膠體 D.向FeCl3溶液中滴入KSCN溶液,溶液顏色變紅 A.A B.B C.C D.D 組卷:23引用:4難度:0.5
三、填空題(共4題,共57分)
-
16.次磷酸鈉(NaH2PO2)是一種白色粉末,微溶于無水乙醇,不溶于乙醚,具有強還原性,酸性條件下易被氧化生成H3PO4。實驗室使用白磷、熟石灰和碳酸鈉溶液模擬工業制備兩步法合成次磷酸鈉晶體。
Ⅰ.制備次磷酸鈣[Ca(H2PO2)2]溶液:(如圖1所示)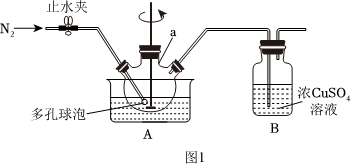
(1)實驗前,經檢驗裝置的氣密性良好。其中儀器a的名稱為。
(2)將一定量的白磷和過量的熟石灰依次投入儀器a中,加水調成稀漿狀,攪拌下加熱升溫到90℃,至無氣體放出時停止反應。則a中發生反應的化學方程式為。
(3)實驗過程中裝置B中出現紅色沉淀,則硫酸銅溶液的作用是。
Ⅱ.制備次磷酸鈉(NaH2PO2)溶液:(如圖2所示)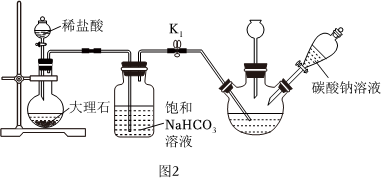
(4)過濾除去未反應的固體物質,然后通入二氧化碳,其目的是,再向次磷酸鈣溶液中加入碳酸鈉溶液,判斷次磷酸鈣完全反應的方法為。
Ⅲ.制備次磷酸鈉晶體:
(5)過濾除去碳酸鈣后將濾液蒸發濃縮,該操作需在條件下進行,再經過冷卻結晶,制得次磷酸鈉晶體。
Ⅳ.測定次磷酸鈉純度:
(6)測量步驟:稱取8.8g樣品溶于水配成25mL溶液置于錐形瓶中,再加鹽酸25mL,準確加入c1mol/L碘標準溶液V1mL,蓋好瓶塞,放在暗處30min。打開瓶塞,用少量蒸餾水洗瓶頸及瓶塞后,以淀粉溶液作指示劑,用c2mol/L硫代硫酸鈉標準溶液進行滴定,消耗硫代硫酸鈉溶液的體積為V2mL(已知I2+2Na2S2O3═Na2S4O6+2NaI)。
①判斷達到滴定終點的現象是。
②晶體中NaH2PO2的質量分數為(列出表達式)。組卷:35引用:4難度:0.5 -
17.鎳是一種硬而有延展性并具有鐵磁性的金屬,它能夠高度磨光和抗腐蝕,工業上用紅土鎳礦[主要成分為Mg3Si2O5(OH)4、Fe2MgO4、NiO、FeO、Fe2O3]為原料,采用硫酸銨焙燒法選擇性提取鎳并回收副產物黃銨鐵礬[化學式可表示為(NH4)xFey(SO4)z(OH)w,摩爾質量為480g/mol]的工藝流程如圖所示
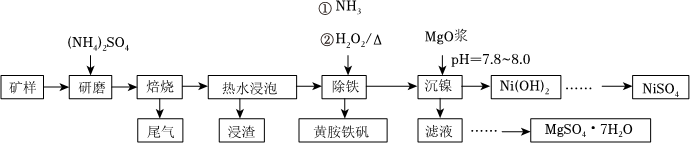
已知:
①2[Mg3Si2O5(OH)4]+9(NH4)2SO43(NH4)2Mg2(SO4)3+12NH3↑+4SiO2+10H2O↑焙燒
②2Fe2MgO4+15(NH4)2SO4(NH4)2Mg2(SO4)3+16NH3↑+4(NH4)3Fe(SO4)3+8H2O↑焙燒
(1)除鐵時加入的H2O2的用量高于理論用量的原因是。
(2)經分析礦樣中大部分鐵仍以氧化物形式存在于“浸渣”中,只有部分FeO在空氣中焙燒時與(NH4)2SO4反應生成Fe2(SO4)3該反應的化學方程式為;“浸渣”的主要成分除含有鐵元素的化合物外還有(填化學式)。
(3)該工藝條件下,Ni2+生成Ni(OH)2沉淀,Fe3+生成Fe(OH)3或黃銨鐵礬沉淀,開始沉淀和沉淀完全時的pH如下表:
若殘留在浸出液中的鐵完全轉化為黃銨鐵礬除去,“除鐵”時通入NH3調節溶液pH的范圍是沉淀物 Ni(OH)2 Fe(OH)3 黃銨鐵礬 開始沉淀時的pH 7.1 2.7 1.3 沉淀完全(c=1×10-5mol/L)時的pH 9.2 3.7 2.3 。
(4)“沉鎳”時pH調為8.0,濾液中Ni2+濃度約為mol/L(100.4≈2.5)
(5)由所得濾液獲得MgSO4?7H2O晶體時,常用無水乙醇代替蒸餾水作洗滌劑,原因是(寫出2點)
(6)對黃銨鐵礬進行熱分解實驗,其結果如圖所示,則黃銨鐵礬的化學式為。(已知:黃銨鐵礬在300℃前分解釋放的物質為H2O,300~575℃之間只有NH3和H2O放出,此時殘留固體只存在Fe、O、S三種元素,670℃以上得到的是純凈的紅棕色粉末)。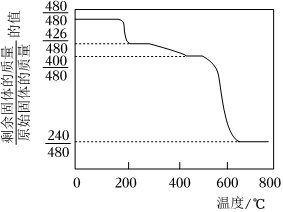 組卷:14引用:2難度:0.6
組卷:14引用:2難度:0.6


