2022-2023學年江蘇省南京師大附中高一(下)期末化學試卷(A卷)
發布:2024/7/8 8:0:10
一、單項選擇題:共16題,每題3分,共48分.每題只有一個選項最符合題意.
-
1.少量Na2O2與H2O反應生成H2O2和NaOH。下列說法正確的是( )
A.Na2O2的電子式為 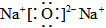
B.H2O的空間構型為直線形 C.H2O2中O元素的化合價為-1 D.NaOH僅含離子鍵 組卷:502引用:5難度:0.5 -
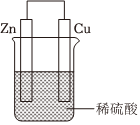 2.關于如圖所示裝置的敘述,正確的是( )
2.關于如圖所示裝置的敘述,正確的是( )A.氫離子在銅片表面被還原 B.銅是負極,銅片上有氣泡產生 C.電子從鋅片經稀硫酸流向銅片 D. 從鋅片經稀硫酸流向銅片SO2-4組卷:24引用:3難度:0.5 -
3.鋼鐵發生電化學腐蝕時,負極發生的反應是( )
A.Fe-2e-=Fe2+ B.2H2O+O2+4e -=4OH- C.2H++2e -=H2↑ D.4OH--4e -=2H2O+O2↑ 組卷:16引用:2難度:0.9 -
4.下列有關金屬冶煉的說法不正確的是( )
A.制Na;電解飽和NaCl溶液 B.制Mg:電解熔融MgCl2 C.制Fe:用焦炭和空氣反應產生的CO在高溫下還原鐵礦石中的鐵的氧化物 D.制Cu:熬膽礬鐵釜,久之亦化為銅 組卷:54引用:1難度:0.5 -
5.下列既屬于氧化還原反應,又屬于吸熱反應的是( )
A.鋁片與稀鹽酸反應 B.灼熱的炭與水蒸氣的反應 C.Ba(OH)2?8H2O與NH4Cl反應 D.甲烷在氧氣中的燃燒反應 組卷:56引用:8難度:0.7 -
6.H2與O2發生反應的過程用模型圖示如下(“-”表示化學鍵):下列說法不正確的是( )
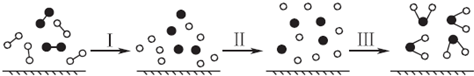
A.過程Ⅰ是吸熱過程 B.過程Ⅲ一定是放熱過程 C.該反應過程所有舊化學鍵都斷裂,且形成了新化學鍵 D.該反應的能量轉化形式只能以熱能的形式進行 組卷:413引用:40難度:0.9
二、非選擇題:共4題,共52分.
-
19.(1)CuCl可用作有機合成的催化劑。CuCl是一種難溶于水和乙醇的白色固體,露置于潮濕空氣中易被氧化。
次磷酸H3PO2是一種強還原劑,將它加入CuSO4水溶液,加熱到40~50℃,析出一種紅棕色的難溶物CuH,次磷酸轉化為磷酸,待CuH生成后將HCl氣體通入,可產生CuCl。寫出生成CuH的化學方程式:。
(2)某同學利用如圖所示裝置,測定高爐煤氣中CO、CO2、N2和O2的百分組成。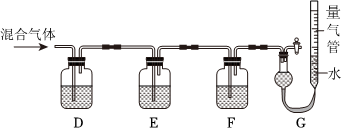
已知:i.CuCl的鹽酸溶液能吸收CO形成Cu(CO)Cl?H2O。
ii.保險粉(Na2S2O4)和KOH的混合溶液能吸收氧氣。
請回答以下問題:
G中測出的是(填物質的化學式)的體積。F洗氣瓶中宜盛放的試劑是。
(3)工業上可以在酸性介質中用H2O2氧化浸出黃銅礦(CuFeS2)。
①CuFeS2反應后轉化為Cu2+、Fe3+、。將1molCuFeS2完全轉化,理論上所需H2O2的物質的量為SO2-4。
②浸出過程中發現,H2O2的反應實際用量遠大于理論用量,原因是。
③若浸出過程中,溶液中含有少量Na2SO4,則會析出黃鈉鐵礬NaFe3(SO4)2(OH)6沉淀。寫出Fe3+轉化為黃鈉鐵礬沉淀的離子方程式:。組卷:16引用:1難度:0.5 -
20.氫能是一種重要能源,氫氣的制備與儲存是研究熱點。
Ⅰ.一種電熱化學循環制氫的方法如圖所示,熔融電解質成分為K2CO3。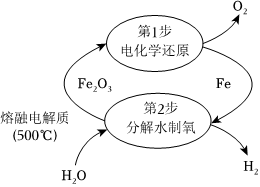
500℃時,Fe2O3能與熔融電解質發生反應:Fe2O3+CO2-32500℃+CO2↑,“電化學還原”步驟中,陰極的電極反應式為FeO-2。
Ⅱ.儲氫的研究包括材料吸氫和脫氫的過程。LiBH4和MgH2都是氫容量(單位質量儲氫材料儲存H2的質量)較大的儲氫材料。
(1)LiBH4、MgH2及兩者混合制成的復合儲氫材料脫氫反應的熱化學方程式如下:
2LiBH4(s)=2LiH(s)+2B(s)+3H2(g)ΔH1=+207kJ?mol-1
MgH2(s)=Mg(s)+H2(g)ΔH2=+75kJ?mol-1
2LiBH4(s)+MgH2(s)=2LiH(s)+MgB2(s)+4H2(g)ΔH3=+184kJ?mol-1
①ΔH3<ΔH1+ΔH2的原因是。
②儲氫材料脫氫的能量變化如圖所示,三種材料中脫氫焓[ΔH(脫氫)]最小的是(填“LiBH4”、“MgH2”或“復合儲氫材料”)。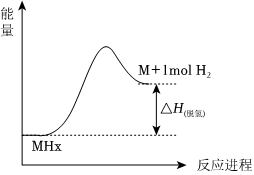
(2)Ti元素有+2、+3、+4等多種價態.向MgH2中添加適量Ti元素后可以加快其釋放H2的速率,其機理示意圖如圖所示。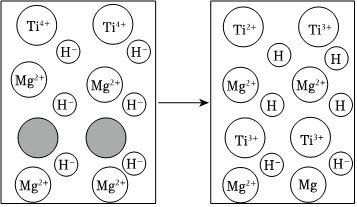
①圖中 表示的微粒是 (用微粒符號表示)。
表示的微粒是 (用微粒符號表示)。
②MgH2釋放H2速率加快的機理可描述為:、Mg2++2Ti2+=Mg+2Ti3+、(用方程式表示反應機理)。組卷:48引用:1難度:0.5


