2022-2023學年江蘇省蘇州市高一(上)期中化學試卷
發布:2024/4/20 14:35:0
一、單項選擇題:包括14題,每題3分,共42分.每題只有一個選項最符合題意.
-
1.我國力爭在2060年前實現“碳中和”,體現了中國對解決氣候問題的大國擔當.在實際生產中,可利用反應CO2+NaOH═NaHCO3來捕捉廢氣中的CO2,下列有關化學用語或說法正確的是( )
A.中子數為8的氧原子: O816B.H、D、T互為同位素 C.Na+的結構示意圖: 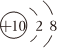
D.NaHCO3的電離方程式:NaHCO3═Na++H++ CO2-3組卷:43引用:5難度:0.6 -
2.膠體在自然界普遍存在,下列事實與膠體無關的是( )
A.將某些膠態金屬氧化物分散于玻璃中制成有色玻璃 B.光線透過樹葉間的縫隙射入密林中時,會看到一道道光柱 C.將納米二氧化硅顆粒(直徑1~100nm)均勻分散到樹脂中形成的分散系 D.植物油與水混合,充分振蕩后可形成油水混合物 組卷:118引用:4難度:0.8 -
3.下列說法正確的是( )
A.分液操作時,應使下層液體從分液漏斗下端管口放出,更換燒杯后再從上口倒出上層液體 B.焰色反應時,鉑絲需用稀硫酸洗凈,并在火焰上灼燒至無色 C.萃取操作時,應選擇有機萃取劑,且萃取劑的密度必須比水大 D.蒸發操作時,應使混合物中的水分完全蒸干后,才能再停止加熱 組卷:88引用:3難度:0.7 -
4.下列反應既屬于氧化還原反應,又屬于化合反應的是( )
A.2NaBr+Cl2═2NaCl+Br2 B.2NO+O2═2NO2 C.Fe2O3+3CO 2Fe+3CO2高溫D.SO2+CaO═CaSO3 組卷:59引用:2難度:0.7 -
5.酸、堿、鹽、氧化物與生產生活密切相關,下列物質性質與用途對應關系不正確的是( )
A.CO具有還原性,可用于冶煉鐵 B.KAl(SO4)2?12H2O(明礬)溶于水后形成膠體,可用于凈水 C.CaO具有吸水性,可用于制作干燥劑 D.NaOH易潮解,可用于氯氣的尾氣吸收 組卷:17引用:1難度:0.7 -
6.下列有關金屬鈉的說法中,不正確的是( )
A.鈉只有在加熱條件下才能與氯氣反應 B.鈉在化學反應中易失去電子,表現出還原性 C.實驗室中少量金屬鈉保存在煤油中 D.鈉鉀合金熔點低,導熱性好,可用作快中子反應堆的熱交換劑 組卷:30引用:2難度:0.7
二、非選擇題:共4題,共58分.
-
17.已知:硫代硫酸鈉(化學式為Na2S2O3)易溶于水,具有強還原性.某實驗室配制100mL0.100mol?L-1Na2S2O3溶液,并用其測定某膽礬樣品中CuSO4?5H2O的純度:
(1)配制上述溶液時需稱量無水硫代硫酸鈉固體的質量為g。
(2)配制過程中不需要使用下列儀器中的(填儀器序號),其中還缺少的玻璃儀器是(填儀器名稱)。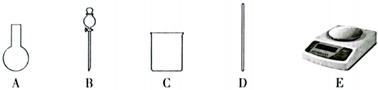
(3)配制時使用的蒸餾水需先煮沸再冷卻,其目的是。
(4)若實驗遇下列情況,導致所配溶液的物質的量濃度偏低的是(填序號)。
A.容量瓶在使用前未干燥,里面有少量蒸餾水
B.轉移溶液至容量瓶過程中,有少量溶液濺出
C.定容時仰視刻度線讀數
D.定容搖勻后發現液面低于容量瓶的刻度線,再加水至刻度線
(5)測定膽礬樣品中CuSO4?5H2O的純度:準確稱取0.500g膽礬樣品,加入適量水溶解,轉移至碘量瓶中,加過量KI溶液并用稀硫酸酸化,再滴加0.100mol?L-1Na2S2O3溶液與生成的I2恰好完全反應時,消耗Na2S2O3溶液19.20mL。上述過程中發生下列反應:2CuSO4+4KI═2CuI↓+I2+2K2SO4;2Na2S2O3+I2═Na2S4O6+2NaI。計算膽礬樣品中CuSO4?5H2O的純度。[純度=×100%,寫出計算過程]m(CuSO4?5H2O)m(樣品)組卷:47引用:1難度:0.6 -
18.某小組同學探究不同條件下氯氣與二價錳化合物的反應。查閱資料顯示:
a.Mn2+在一定條件下能被Cl2或ClO-氧化成MnO2(棕黑色)、(綠色)、MnO2-4(紫色)。MnO-4
b.濃堿條件下,可被OH-還原為MnO-4。MnO2-4
c.Cl2的氧化性與溶液的酸堿性無關,NaClO的氧化性隨堿性增強而減弱。
d.Mn(OH)2為白色沉淀。
實驗裝置如圖(夾持裝置略):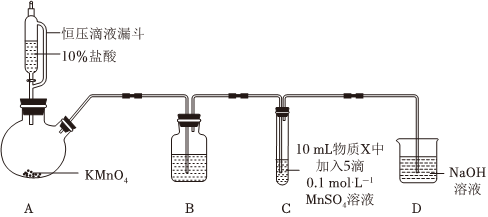
(1)A中發生的反應的化學方程式如下:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O。用雙線橋標出該反應中電子轉移的方向和數目序號 物質X C中實驗現象 通入Cl2前 通入Cl2后 Ⅰ 水 得到無色溶液 產生棕黑色沉淀,且放置后不發生變化 Ⅱ 5%NaOH溶液 產生白色沉淀,在空氣中緩慢變成棕黑色沉淀 棕黑色沉淀增多,放置后溶液變為紫色,仍有沉淀 Ⅲ 40%NaOH溶液 產生白色沉淀,在空氣中緩慢變成棕黑色沉淀 棕黑色沉淀增多,放置后溶液變為紫色,仍有沉淀 。
(2)通入Cl2前,Ⅱ、Ⅲ中沉淀由白色變為棕黑色的化學方程式為。
(3)對比實驗Ⅰ、Ⅱ通入Cl2后的實驗現象,對于Mn2+還原性與溶液酸堿性的認識是。
(4)根據資料b,Ⅲ中應得到綠色溶液,而實驗中得到紫色溶液,分析現象與資料不符的原因:
原因一:可能是通入Cl2導致溶液的堿性減弱。
原因二:可能是氧化劑過量,氧化劑將氧化為MnO2-4。MnO-4
①用化學方程式表示可能導致溶液堿性減弱的原因:。
②取Ⅲ中放置后的1mL懸濁液,加入4mL40%NaOH溶液,觀察到溶液紫色迅速變為綠色,且有無色無味的氣體產生,該氣體的化學式為,同時還可觀察到溶液的綠色緩慢加深,即可證明Ⅲ的懸濁液中氧化劑過量。
③從化學反應進行的快慢的角度,分析實驗Ⅲ未得到綠色溶液的可能原因:。組卷:119引用:3難度:0.3


