2021-2022學年黑龍江省雞西市雞東二中高二(上)期中化學試卷(理科)
發布:2024/4/20 14:35:0
一、單選題(1-15每題2分,16-20每題3分,共45分)
-
1.H2與O2發生反應的過程用模型圖示如下(“-”表示化學鍵):下列說法不正確的是( )
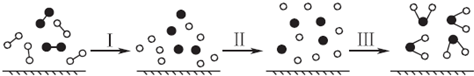
A.過程Ⅰ是吸熱過程 B.過程Ⅲ一定是放熱過程 C.該反應過程所有舊化學鍵都斷裂,且形成了新化學鍵 D.該反應的能量轉化形式只能以熱能的形式進行 組卷:413引用:40難度:0.9 -
2.已知熱化學方程式:①CO(g)+
O2(g)=CO2(g)△H=-283.0kJ?mol-112
②H2(g)=O2(g)=H2O(g)△H=-241.8kJ?mol-112
據此判斷下列說法正確的是( )A.H2(g)= O2(g)=H2O(I)△H>-241.8kJ?mol-112B.H2的燃燒熱△H=-241.8 kJ.mol-1 C.H2(g)轉變成H2O(g)的化學反應一定放出能量 D.CO(g)+H2O(g)=CO2(g)+H2(g)的△H=-41.2kJ?mol-1 組卷:80引用:6難度:0.9 -
3.在25℃、101KPa時,C(s)、H2(g)、CH3COOH(1)的燃燒熱分別為393.5kJ?mol-1、285.8kJ?mol-1、870.3kJ?mol-1,則2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反應熱為( )
A.-488.3kJ?mol-1 B.+488.3kJ?mol-1 C.-191kJ?mol-1 D.+191kJ?mol-1 組卷:103引用:20難度:0.6 -
4.下列說法正確的是( )
A.若2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1,則H2燃燒熱為241.8kJ?mol-1 B.在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,若將含0.6molH2SO4的稀硫酸與含1molNaOH的溶液混合,放出的熱量大于57.3kJ C.已知C(石墨,s)═C(金剛石,s)△H>0,則金剛石比石墨穩定 D.由BaSO4(s)+4C(s)=4CO(g)+BaS(s)△H1=+571.2kJ?mol-1①
BaSO4(s)+2C(s)=2CO2(g)+BaS(s)△H2=+226.2kJ?mol-1②可得反應C(s)+CO2(g)=2CO(g) 的△H=+172.5kJ?mol-1組卷:9引用:2難度:0.7 -
5.已知299K時,合成氨反應N2(g)+3H2(g)?2NH3(g)△H=-92.0kJ/mol,將此溫度下的1mol N2和3mol H2放在一密閉容器中,在催化劑存在時進行反應,測得反應放出的熱量為(忽略能量損失)( )
A.一定小于92.0 kJ B.一定等于92.0 kJ C.一定大于92.0 kJ D.不能確定 組卷:64引用:25難度:0.7 -
6.將4mol A氣體和2mol B氣體在2L的容器中混合并在一定條件下發生如下反應:2A(g)+B(g)?2C(g)。若經2s后測得C的濃度為0.6mol?L-1,現有下列幾種說法:
①用物質A表示的反應平均速率為0.3mol?L-1?s-1
②物質B表示的反應的平均速率為0.6mol?L-1?s-1
③2s時物質A的轉化率為70%
④2s時物質B的濃度為0.7mol?L-1
其中正確的是( )A.①③ B.①④ C.②③ D.③④ 組卷:17引用:10難度:0.7 -
7.在容積一定的密閉容器中,置入一定量的一氧化氮和足量碳發生化學反應:C (s)+2NO(g)?CO2(g)+N2(g),平衡時c (NO)與溫度T的關系如圖所示,則下列說法正確的是( )
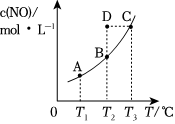
A.該反應的△H>0 B.若該反應在T1、T2時的平衡常數分別為K1、K2,則K1<K2 C.在T2時,若反應體系處于狀態D,則此時v正>v逆 D.若狀態B、C、D的壓強分別為PB、PC、PD,則 PC=PD>PB 組卷:157引用:19難度:0.7 -
8.電解質溶液有許多奇妙之處,你只有深入思考,才能體會到它的樂趣.下列關于電解質溶液的敘述中正確的是( )
A.Na2CO3、NaHCO3兩種鹽溶液中,離子種類不相同 B.常溫下,1 mol?L-1的CH3COOH溶液與1 mol?L-1的NaOH溶液等體積混合后,所得混合液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) C.物質的量濃度相同的NH4Cl和NH4HSO4兩種溶液中,c( )前者小于后者NH+4D.常溫下,某溶液中由水電離出的c(H+)=10-5 mol?L-1,則此溶液可能是鹽酸 組卷:44引用:15難度:0.7
二、非選擇題(共4題,55分)
-
 24.工業上可用CO或CO2來生產燃料甲醇.已知甲醇制備的有關化學反應以及在不同溫度下的化學反應平衡常數如下表所示:
24.工業上可用CO或CO2來生產燃料甲醇.已知甲醇制備的有關化學反應以及在不同溫度下的化學反應平衡常數如下表所示:
(1)據反應①與②可推導出K1、K2與K3之間的關系,則K3=化學反應 平衡
常數溫度/℃ 500 800 ①2H2(g)+CO(g)?CH3OH(g) K1 2.5 0.15 ②H2(g)+CO2(g)?H2O(g)+CO(g) K2 1.0 2.50 ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) K3 (用K1、K2表示).
500℃時測得反應③在某時刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的濃度(mol?L-1)分別為0.8、0.1、0.3、0.15,則此時v正v逆(填“>”、“=”或“<”).
(2)在3L容積可變的密閉容器中發生反應②,已知c(CO)-反應時間t變化曲線Ⅰ如圖所示,若在t0時刻分別改變一個條件,曲線Ⅰ變為曲線Ⅱ和曲線Ⅲ.當曲線Ⅰ變為曲線Ⅱ時,改變的條件是.當曲線Ⅰ變為曲線Ⅲ時,改變的條件是.組卷:177引用:6難度:0.1 -
 25.利用CO和H2可以合成甲醇,反應原理為CO(g)+2H2(g)═CH3OH(g).一定條件下,在容積為V L的密閉容器中充入a mol CO與2a mol H2合成甲醇,平衡轉化率與溫度、壓強的關系如圖所示.
25.利用CO和H2可以合成甲醇,反應原理為CO(g)+2H2(g)═CH3OH(g).一定條件下,在容積為V L的密閉容器中充入a mol CO與2a mol H2合成甲醇,平衡轉化率與溫度、壓強的關系如圖所示.
(1)p1p2(填“>”、“<”或“=”),理由是.
(2)該甲醇合成反應在A點的平衡常數K=(用a和V表示).
(3)該反應達到平衡時,反應物轉化率的關系是COH2.(填“>”、“<”或“=”)
(4)下列措施中能夠同時滿足增大反應速率和提高CO轉化率的是(填字母).
A.使用高效催化劑
B.降低反應溫度
C.增大體系壓強
D.不斷將CH3OH從反應混合物中分離出來組卷:49引用:5難度:0.3


