滬教版高三(上)高考題單元試卷:第5章 氧化還原反應、電化學(01)
發布:2024/4/20 14:35:0
一、選擇題(共25小題)
-
1.下列物質在生活中應用時,起還原作用的是( )
A.明礬作凈水劑 B.甘油作護膚保濕劑 C.漂粉精作消毒劑 D.鐵粉作食品袋內的脫氧劑 組卷:1765引用:50難度:0.9 -
2.化學與生活密切相關。下列應用中利用了物質氧化性的是( )
A.明礬凈化水 B.純堿去油污 C.食醋除水垢 D.漂白粉漂白織物 組卷:1487引用:39難度:0.9 -
3.工業上將Na2CO3和Na2S以1:2的物質的量之比配成溶液,再通入SO2,可制取Na2S2O3,同時放出CO2,在該反應中( )
A.硫元素既被氧化又被還原 B.氧化劑與還原劑的物質的量之比為1:2 C.每生成1 mol Na2S2O3,轉移4 mol電子 D.相同條件下,每吸收10 m3SO2就會放出2.5 m3CO2 組卷:94引用:29難度:0.7 -
4.根據反應①2FeCl3+2KI═2FeCl2+2KCl+I2,②2FeCl2+Cl2=2FeCl3,判斷下列物質的氧化性由強到弱的順序中,正確的是( )
A.Fe3+>Cl2>I2 B.Cl2>I2>Fe3+ C.I2>Cl2>Fe3+ D.Cl2>Fe3+>I2 組卷:1479引用:48難度:0.9 -
5.某金屬單質跟一定濃度的硝酸反應,假定只產生單一的還原產物.當參加反應的單質與被還原的硝酸的物質的量之比為2:1時,還原產物可能為( )
A.NO2 B.NO C.N2O D.N2 組卷:498引用:39難度:0.9 -
6.根據反應式:(1)2Fe3++2I-=2Fe2++I2,(2)Br2+2Fe2+=2Fe3++2Br-,判斷下列離子的還原性由強到弱的順序是( )
A.Br-、Fe2+、I- B.I-、Fe2+、Br- C.Br-、I-、Fe2+ D.Fe2+、I-、Br- 組卷:2229引用:102難度:0.9 -
7.銀制器皿日久表面會逐漸變黑,這是生成了Ag2S的緣故.根據電化學原理可進行如下處理:在鋁質容器中加入食鹽溶液,再將變黑的銀器浸入該溶液中,一段時間后發現黑色會褪去.下列說法正確的是( )
A.處理過程中銀器一直保持恒重 B.銀器為正極,Ag2S被還原生成單質銀 C.該過程中總反應為2Al+3Ag2S═6Ag+Al2S3 D.黑色褪去的原因是黑色Ag2S轉化為白色AgCl 組卷:3026引用:44難度:0.9 -
8.某同學組裝了如圖所示的電化學裝置,電極Ⅰ為Al,其它均為Cu,則( )
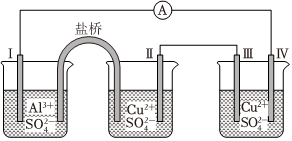
A.電流方向:電極Ⅳ→A→電極Ⅰ B.電極Ⅰ發生還原反應 C.電極Ⅱ逐漸溶解 D.電極Ⅲ的電極反應:Cu2++2e-═Cu 組卷:2997引用:63難度:0.7 -
9.在一定條件下,PbO2與Cr3+反應,產物是Cr2
和Pb2+,則與1mol Cr3+反應所需PbO2的物質的量為( )O2-7A.3.0mol B.1.5mol C.1.0mol D.0.75mol 組卷:1676引用:57難度:0.9 -
10.下列說法不正確的是( )
A.多孔碳可用作氫氧燃料電池的電極材料 B.pH計不能用于酸堿中和滴定終點的判斷 C.科學家發現一種新細菌的DNA鏈中有砷(As)元素,該As元素最有可能取代了普通DNA鏈中的P元素 D. 和CO2反應生成可降解聚合物
,反應符合綠色化學的原則
組卷:578引用:15難度:0.9
二、解答題(共5小題)
-
 29.化學在環境保護中起著十分重要的作用,催化反硝化法和電化學降解法可用于治理水中硝酸鹽的污染。
29.化學在環境保護中起著十分重要的作用,催化反硝化法和電化學降解法可用于治理水中硝酸鹽的污染。
(1)催化反硝化法中,H2能將還原為N2.25℃時,反應進行10min,溶液的pH由7變為12。NO-3
①N2的結構式為。
②上述反應的離子方程式為,其平均反應速率υ()為NO-3mol?L-1?min-1。
③還原過程中可生成中間產物,寫出3種促進NO-2水解的方法NO-2。
(2)電化學降解的原理如圖所示。NO-3
①電源正極為(填A或B),陰極反應式為。
②若電解過程中轉移了2mol電子,則膜兩側電解液的質量變化差(Δm左-Δm右)為g。組卷:1285引用:25難度:0.1 -
30.在一定條件下,NO跟NH3可以發生反應生成N2和H2O,現有NO和NH3的混合物1mol,充分反應后所得產物中,若經還原得到的N2比經氧化得到的N2多1.4g.
(1)寫出反應的化學方程式并標出電子轉移的方向和數目.
(2)若以上反應進行完全,試計算原反應混合物中NO和NH3的物質的量可能各是多少.組卷:287引用:27難度:0.3


