2020-2021學年吉林省延邊州汪清四中高二(下)第二次段考化學試卷
發布:2024/4/20 14:35:0
一、單選題(共40分)
-
1.下列原子或離子原子核外電子排布不屬于基態排布的是( )
A.Na 1s22s22p53s2 B.S2- 1s22s22p63s23p6 C.N 1s22s22p3 D.Si 1s22s22p63s23p2 組卷:30引用:4難度:0.9 -
2.下列分子或離子的中心原子的雜化軌道類型和空間結構不正確的是( )
A.BF3中B原子采取sp2雜化,為平面三角形結構 B.PH4+中P原子采取sp3雜化,為正四面體形結構 C.BeCl2中Be原子采取sp雜化,為V形結構 D.NH2-中N原子采取sp3雜化,為V形結構 組卷:55引用:2難度:0.6 -
3.下列說法中正確的是( )
A.同一原子中,1s、2s、3s電子的能量逐漸減小 B.同一原子中,2p、3p、4p能級的軌道數依次增多 C.能量高的電子在離核近的區域運動,能量低的電子在離核遠的區域運動 D.各能層含有的能級數為n(n為能層序數) 組卷:37引用:8難度:0.9 -
4.已知鋰和鎂在元素周期表中有特殊“對角線”關系,它們的性質非常相似.下列有關鋰及其化合物敘述正確的是( )
A.Li2SO4難溶于水 B.Li與N2反應產物是Li3N C.LiOH易溶于水 D.LiOH與Li2CO3受熱都很難分解 組卷:75引用:12難度:0.9 -
5.電子由3d能級躍遷至4p能級時,可通過光譜儀直接攝取( )
A.電子的運動軌跡圖象 B.原子的吸收光譜 C.電子體積大小的圖象 D.原子的發射光譜 組卷:360引用:22難度:0.7 -
6.鄰羥基苯甲醛比對羥基苯甲醛熔、沸點低的原因是( )
A.鄰羥基苯甲醛不形成氫鍵,而對羥基苯甲醛能夠形成氫鍵 B.鄰羥基苯甲醛形成分子內氫鍵,而對羥基苯甲醛能夠形成分子間氫鍵 C.對羥基苯甲醛比鄰羥基苯甲醛體積小,分子更緊湊 D.對羥基苯甲醛比鄰羥基苯甲醛對稱性高 組卷:45引用:3難度:0.9 -
7.金屬具有延展性的原因是( )
A.金屬原子半徑都較大,價電子較小 B.金屬受外力作用變形時,金屬陽離子與自由電子間仍保持較強烈作用 C.金屬中大量自由電子受外力作用時,運動速度加快 D.自由電子受外力作用時能迅速傳遞能量 組卷:194引用:8難度:0.9 -
8.下列關于原子晶體、分子晶體的敘述中,正確的是( )
A.在SiO2晶體中,1個硅原子和2個氧原子形成2個共價鍵 B.晶體中分子間作用力越大,分子越穩定 C.HI的相對分子質量大于HF,所以HI 的沸點高于HF D.金剛石為網狀結構,由共價鍵形成的碳原子環中,最小環上有6個碳原子 組卷:199引用:4難度:0.6
二、填空題(共60分)
-
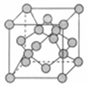 23.三價鉻離子(Cr3+)是葡萄糖耐量因子(GTF)的重要組成成分,CTF能夠協助胰島素發揮作用。構成葡萄糖耐量因子和蛋白質的元素有C、H、O、N、S、Cr等。回答下列問題:
23.三價鉻離子(Cr3+)是葡萄糖耐量因子(GTF)的重要組成成分,CTF能夠協助胰島素發揮作用。構成葡萄糖耐量因子和蛋白質的元素有C、H、O、N、S、Cr等。回答下列問題:
(1)Cr的價層電子排布式為。
(2)O、N、S的原子半徑由大到小的順序為。
(3)SO2分子的VSEPR模型名稱為,其中心原子的雜化方式為。
(4)化學式為CrCl3?6H2O的化合物有多種結構,其中一種可表示為[CrCl2(H2O)4]Cl?2H2O,該物質的配離子中提供孤電子對的原子為,配位數為。
(5)NH3分子可以與H+結合生成NH4+,這個過程發生改變的是。(填序號)
a.微粒的空間結構
b.N原子的雜化類型
c.H-N-H鍵角
d.微粒的電子數
(6)由碳元素形成的某種晶體的晶胞結構如圖所示,若阿伏加德羅常數的值為NA,晶體密度為ρg?cm-3,則該晶胞的棱長為pm。組卷:3引用:2難度:0.4 -
24.新材料的出現改變了人們的生活,對新材料的研究越來越重要。
(1)硫化鋅在熒光體、光導體材料、涂料、顏料等行業中應用廣泛。其晶胞結構如圖1所示,a位置是S2-、b位置Zn2+,則此晶胞中含有個S2-,Zn2+的配位數為。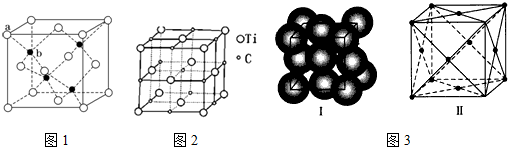
(2)最近發現一種鈦原子和碳原子構成的氣態團簇分子,如圖2所示,頂角和面心的原子是鈦原子,棱的中心和體心的原子是碳原子,它的化學式為。
(3)由甲烷分子,在一定條件下可以得到“碳正離子”CH3+,和“碳負離子”CH3-,CH3+中C-H鍵鍵角是;CH3-的空間構型是。
(4)某金屬材料的結構如圖3所示,屬于面心立方的結構,晶胞結構如圖4所示。若金屬的原子半徑為r pm,金屬的摩爾質量為M g/mol,NA是阿伏加德羅常數的值。金屬的密度為ρ=g/cm3。
(5)Zn與Cu的第一電離能:Zn(填“>”“<”或“=”)Cu,其理由是。組卷:12引用:1難度:0.4


