2020-2021學年遼寧省沈陽市五校高一(下)聯考化學試卷(6月份)
發布:2024/11/21 15:30:3
一、單項選擇題(本題包括15小題,每小題3分,共45分)
-
1.1996年出生的中國學者曹原,2010年以理科總分669考入中國科學技術大學少年班,之后進入美國麻省理工學院讀博士,截至2021年,已在全球頂尖學術期刊《Nature》發表五篇論文,其研究發現,將兩層石墨烯堆成約1.1°的微妙角度,就會產生神奇的超導效應。石墨烯可以用微機械剝離法從石墨中分離制得,下列關于這種新材料的說法錯誤的是( )
A.屬于烯烴 B.具有導電性 C.是一種碳單質 D.化學性質穩定 組卷:6引用:1難度:0.7 -
2.對下列化學用語的理解正確的是( )
A.苯的分子式 
B.丙烷分子的球棍模型 
C.甲酸乙酯的結構簡式CH3COOCH3 D.空間充填模型  既可以表示甲烷分子,也可以表示四氯化碳分子組卷:10引用:1難度:0.7
既可以表示甲烷分子,也可以表示四氯化碳分子組卷:10引用:1難度:0.7 -
3.有人設想合成具有以下結構的四種烴分子,下列有關說法不正確的是( )
A. 
1 mol甲分子內含有10 mol共價鍵B. 
由乙分子構成的物質不能發生氧化反應C. 
丙分子的二氯取代產物只有三種D. 
分子丁顯然是不可能合成的組卷:83引用:11難度:0.7 -
4.下列各物質,一定是同系物的是( )
A.分子式為C4H6和C5H8的烴 B.分子式為C3H8O和CH4O的有機物 C.符合CnH2n通式的烴 D.分子式為C4H10和C3H8的烴 組卷:32引用:1難度:0.8 -
5.某種分子的球棍模型如下圖所示(圖中球與球之間的連線可代表單鍵、雙鍵、三鍵等);不同形式的球代表不同的原子,對該物質的判斷正確的是( )

A.①處的化學鍵是碳碳雙鍵 B.③處的原子可能是氯原子 C.該分子有五個三鍵 D.該分子中的原子不可能均在同一直線上 組卷:8引用:1難度:0.7 -
6.節日之際,一種“本寶寶福祿雙全”的有機物曾經被人們廣泛轉發,其結構簡式為
 ,該物質的同分異構體中具有“本寶寶福祿雙全”諧音且兩個醛基相對位置不變的有機物還有( )
,該物質的同分異構體中具有“本寶寶福祿雙全”諧音且兩個醛基相對位置不變的有機物還有( )A.3種 B.4種 C.5種 D.6種 組卷:88引用:2難度:0.5
二、非選擇題(本題包括4小題,共55分)
-
 18.碳氧化物之間、簡單烴之間的化學轉化一直是人們研究和關注的方向之一。
18.碳氧化物之間、簡單烴之間的化學轉化一直是人們研究和關注的方向之一。
一定條件下鐵可以和CO2發生反應Fe(s)+CO2(g)?FeO(s)+CO(g)ΔH>0。一定溫度下,向某密閉容器中加入足量鐵粉并充入一定量的CO2氣體,反應過程中CO2氣體和CO氣體的濃度與時間的關系如圖所示。
(1)t1時,正、逆反應速率的大小關系為v正v逆(填“>”“<”或“=”)。
(2)4分鐘內,CO2的轉化率為( 寫成百分數保留小數點后一位);CO的平均反應速率v(CO)=;該溫度下反應的平衡常數為。
(3)下列條件的改變能減慢其反應速率的是。(選填序號)
①降低溫度
②減少鐵粉的質量
③保持壓強不變充入He
④保持體積不變充入He
(4)反應產物之一CO可設計成燃料電池。CO-空氣燃料電池是一種酸性(稀硫酸溶液)燃料電池,電池放電時,溶液中趨向正極移動的離子是,負極的電極反應式為。
(5)甲烷裂解法制取乙炔的反應方程式為:2CH4(g)?C2H2(g)+3H2(g),判斷該反應ΔS0(填>或<)。
已知:CH4 (g)+2O2 (g)═CO2 (g)+2H2O (l)ΔH1=akJ?mol-1
C2H2 (g)+2.5O2 (g)═2CO2 (g)+H2O (l)ΔH2=bkJ?mol-1
2H2 (g)+O2 (g)═2H2O (l)ΔH3=ckJ?mol-1
則2CH4(g)?C2H2(g)+3H2(g)ΔH=kJ?mol-1 (用含a、b、c的代數式表示)。組卷:11引用:1難度:0.7 -
19.研究NOx之間的轉化具有重要意義。
(1)已知:N2O4(g)?2NO2(g)ΔH>0
將一定量N2O4氣體充入恒容的密閉容器中,控制反應溫度為T1。
①下列可以作為反應達到平衡的判據是。
A.氣體的壓強不變B.v正(N2O4)=2v逆(NO2)C.K不變
D.容器內氣體的密度不變E.容器內顏色不變
②t1時刻反應達到平衡,混合氣體平衡總壓強為p,N2O4氣體的平衡轉化率為75%,則反應N2O4(g)═2NO2(g)的平衡常數Kp=(對于氣相反應,用某組分B的平衡壓強p(B)代替物質的量濃度c(B)也可表示平衡常數,記作Kp,如p(B)=p?x(B),p為平衡總壓強,x(B)為平衡系統中B的物質的量分數)。
③反應溫度T1時,c(N2O4)隨t(時間)變化曲線如圖1,畫出0~t2時段,c(NO2)隨t變化曲線。
保持其它條件不變,改變反應溫度為T2(T2>T1),再次畫出0~t2時段,c(NO2)隨t變化趨勢的曲線。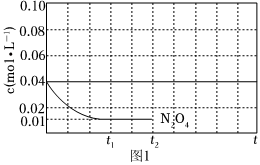
(2)NO氧化反應:2NO(g)+O2(g)═2NO2(g)分兩步進行,其反應過程能量變化示意圖如圖2。
Ⅰ2NO(g)→N2O2(g)ΔH1
ⅡN2O2(g)+O2(g)→2NO2(g)ΔH2
①決定NO氧化反應速率的步驟是(填“Ⅰ”或“Ⅱ”)。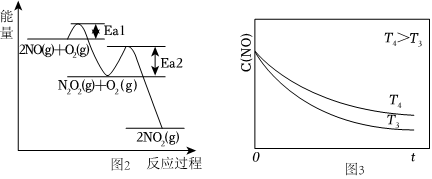
②在恒容的密閉容器中充入一定量的NO和O2氣體,保持其它條件不變,控制反應溫度分別為T3和T4(T4>T3),測得c(NO)隨t(時間)的變化曲線如圖3。
轉化相同量的NO,在溫度(填“T3”或“T4”)下消耗的時間較長,試結合反應過程能量圖(圖2)分析其原因。組卷:474引用:9難度:0.7


