2023-2024學(xué)年浙江省杭州市四校聯(lián)考高二(上)月考化學(xué)試卷(10月份)
發(fā)布:2024/9/13 7:0:8
一、選擇題(本大題共16小題,每小題3分,共48分。每小題列出的四個備選項中只有一個符合題目要求的,不選、多選、錯選均不得分)
-
1.中華民族的發(fā)明創(chuàng)造為人類文明進步做出了巨大貢獻,下列過程主要是利用化學(xué)反應(yīng)中能量變化的是( )
A B C D 
神十一載人飛船發(fā)射
糧食釀醋
濕法煉銅
打磨磁石制司南A.A B.B C.C D.D 組卷:4引用:6難度:0.8 -
2.下列事實不能用化學(xué)平衡移動原理解釋的是( )
A.實驗室收集氯氣時,常用排飽和食鹽水的方法 B.將混合氣體中的氨液化有利于合成氨反應(yīng) C.鋅與稀硫酸反應(yīng),加入少量硫酸銅反應(yīng)速率會加快 D.實驗室檢驗 的方法:取少量待測液于試管中,加入濃NaOH溶液并加熱,將濕潤的紅色石蕊試紙放在試管口NH+4組卷:23引用:1難度:0.6 -
3.根據(jù)Ca(OH)2/CaO體系的能量循環(huán)圖,下列說法正確的是( )
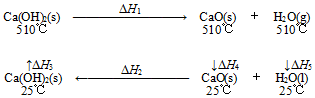
A.△H5>0 B.△H1+△H2=0 C.△H3=△H4+△H5 D.△H1+△H2+△H3+△H4+△H5=0 組卷:101引用:13難度:0.5 -
4.下列有關(guān)熱化學(xué)方程式的敘述正確的是( )
A.已知2H2(g)+O2(g)═2H2O(g)ΔH=-483.6kJ/mol,則H2的燃燒熱為-241.8kJ/mol B.已知2C(s)+2O2(g)═2CO2(g)ΔH1;2C(s)+O2(g)═2CO(g)ΔH2,則ΔH1>ΔH2 C.含20.0gNaOH的稀溶液與稀鹽酸完全中和,放出28.7kJ的熱量,則該反應(yīng)的熱化學(xué)方程式為:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)ΔH=-57.4kJ/mol D.已知2SO2(g)+O2(g)?2SO3(g)ΔH=-QkJ?mol-1(Q>0),則將2molSO2(g)和1molO2(g)置于一密閉容器中充分反應(yīng)后放出QkJ的熱量 組卷:15引用:1難度:0.7 -
5.下列實驗現(xiàn)象或圖像信息能充分說明相應(yīng)的化學(xué)反應(yīng)是放熱反應(yīng)的是( )
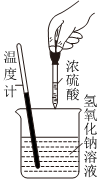
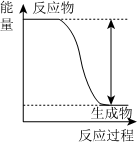
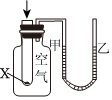
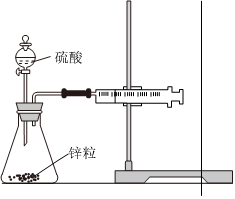
A.溫度計的水銀柱不斷上升 B.反應(yīng)物總能量大于生成物總能量 C.往試管中加水后,甲處液面低于乙處液面 D.反應(yīng)開始后,針筒活塞向右移動 A.A B.B C.C D.D 組卷:25引用:2難度:0.7 -
6.已知:2CH3CH2CH2CH3(g)+13O2(g)→8CO2(g)+10H2O(l);ΔH=-5758kJ/mol
2(CH3)2CHCH3(g)+13O2(g)→8CO2(g)+10H2O(l);ΔH=-5738kJ/mol
下列說法正確的是( )A.等物質(zhì)的量的正丁烷分子儲存的能量大于異丁烷分子 B.正丁烷的穩(wěn)定性大于異丁烷 C.異丁烷轉(zhuǎn)化為正丁烷的過程是一個放熱過程 D.異丁烷分子中的碳氫鍵的數(shù)量比正丁烷的多 組卷:11引用:1難度:0.7 -
7.下列有關(guān)中和熱實驗的說法正確的是( )
A.用銅絲替代環(huán)形玻璃攪拌棒,測得△H偏高 B.強酸與強堿反應(yīng)生成1mol水的△H都約為-57.3kJ?mol-1 C.測定中和熱實驗中,讀取混合溶液不再變化的溫度為終止溫度 D.某同學(xué)通過實驗測出稀鹽酸和稀NaOH溶液反應(yīng)的中和熱△H=-52.3kJ?mol-1 ,造成這一結(jié)果的原因不可能是:用測量鹽酸的溫度計直接測定NaOH溶液的溫度 組卷:158引用:7難度:0.7
二、填空題(本大題共4題,共52分。)
-
20.二氧化碳的轉(zhuǎn)化和利用成為實現(xiàn)“碳達峰”、“碳中和”的重要研究課題二氧化碳加氫制甲醇涉及的反應(yīng)可表示為:
①CO2(g)+H2(g)?CO(g)+H2O(g)ΔH1
②CO(g)+2H2(g)?CH3OH(g)ΔH2=-90kJ?mol-1
③CO2(g)+3H2(g)?CH3OH(g)+H2O(g)ΔH3=-49kJ?mol-1
(1)根據(jù)上述反應(yīng)求:④CO(g)+H2O(g)?CO2(g)+H2(g)ΔH4=。
(2)我國學(xué)者結(jié)合實驗與計算機模擬結(jié)果,研究了在金催化劑表面上反應(yīng)④的反應(yīng)歷程,如圖所示,其中吸附在金催化劑表面上的物種用*標(biāo)注。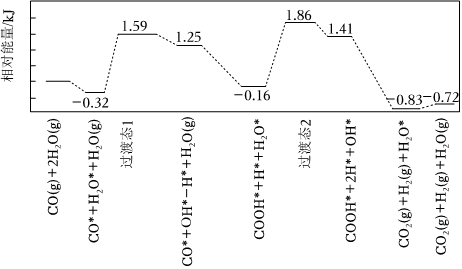
寫出該歷程中決速步驟的化學(xué)方程式:。
(3)在一體積可變的密閉容器中,在保持aMPa下,按照=3投料,平衡時,CO和CH3OH在含碳產(chǎn)物中物質(zhì)的量分數(shù)及CO2的轉(zhuǎn)化率隨溫度的變化如圖所示:n(H2)n(CO2)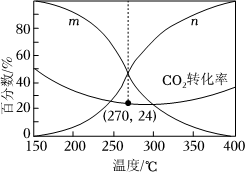
①圖中m曲線代表的物質(zhì)為。
②下列說法正確的是(填標(biāo)號)。
A.180~380℃范圍內(nèi),H2的平衡轉(zhuǎn)化率始終低于CO2
B.溫度越高,越有利于工業(yè)生產(chǎn)CH3OH
C.一定時間內(nèi)反應(yīng),加入選擇性高的催化劑,可提高CH3OH的產(chǎn)率
D.150~400℃范圍內(nèi),隨著溫度的升高,CO2的反應(yīng)速率先減小后增大
③已知氣體分壓=氣體總壓×氣體的物質(zhì)的量分數(shù),用平衡分壓代替平衡濃度可以得到平衡常數(shù)Kp,270℃時反應(yīng)①的分壓平衡常數(shù)為(保留2位有效數(shù)字)。
(4)為了提高甲醇的選擇性,CH3OH的選擇性是指轉(zhuǎn)化的CO2中生成CH3OH的百分比,某科研團隊研制了一種具有反應(yīng)和分離雙功能的分子篩膜催化反應(yīng)器,原理如圖所示。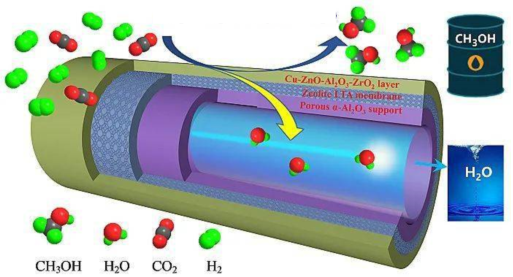
保持壓強為3MPa,溫度為260℃,向密閉容器中按投料比=3投入一定量CO2和H2,不同反應(yīng)模式下CO2的平衡化率和CH3OH的選擇性的相關(guān)實驗數(shù)據(jù)如下表所示。n(H2)n(CO2)
由表中數(shù)據(jù)可知,在分子篩膜催化反應(yīng)器模式下,CO2的轉(zhuǎn)化率明顯提高,結(jié)合具體反應(yīng)分析可能的原因是實驗 反應(yīng)模式 CO2的平衡轉(zhuǎn)化率 CH3OH的選擇性 ① 普通催化反應(yīng)器 21.9 67.3 ② 分子篩膜催化反應(yīng)器 36.1 100.0 。組卷:32引用:1難度:0.5 -
 21.乙酸乙酯一般通過乙酸和乙醇酯化合成:
21.乙酸乙酯一般通過乙酸和乙醇酯化合成:
CH3COOH(l)+C2H5OH(l)CH3COOC2H5(l)+H2O(l)濃H2SO4
(1)一定溫度下該反應(yīng)的平衡常數(shù)K=4.00。若按化學(xué)方程式中乙酸和乙醇的化學(xué)計量數(shù)比例投料,則乙酸的平衡轉(zhuǎn)化率α=(保留3個有效數(shù)字)
(2)若乙酸和乙醇的物質(zhì)的量之比為n:1,相應(yīng)平衡體系中乙酸乙酯的物質(zhì)的量分數(shù)為x,請在如圖中繪制x隨n變化的示意圖(計算時不計副反應(yīng))。組卷:11引用:1難度:0.5


