2021-2022學年西藏拉薩那曲高級中學高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題:(每小題4分,共48分)
-
1.下列關于化學反應能量變化的敘述正確的是( )
A.生成物總能量一定低于反應物總能量 B.應用蓋斯定律可計算某些難以直接測量的反應的焓變 C.同溫同壓下,H2(g)+Cl2(g)═2HCl(g)在光照和點燃條件下的△H不同 D.放熱反應的反應速率總是大于吸熱反應的反應速率 組卷:14引用:2難度:0.9 -
2.下列說法或表示方法中正確的是( )
A.等質量的硫蒸氣和硫磺分別完全燃燒,后者放出的熱量多 B.氫氣的燃燒熱為285.8kJ?mol-1,則氫氣燃燒的熱化學方程式為:2H2(g)+O2(g)═2H2O(l);△H=-285.8 kJ?mol-1 C.已知中和熱為57.3 kJ?mol-1,若將含0.5mol H2SO4的濃溶液與含1mol NaOH的溶液混合,放出的熱量要大于57.3 kJ D.Ba(OH)2?8H2O(s)+2NH4Cl(s)═BaCl2(s)+2NH3(g)+10H2O(l);△H<0 組卷:19引用:2難度:0.7 -
3.下列圖象分別表示有關反應的反應過程與能量變化的關系,據此判斷下列說法中不正確的是( )
A. 
石墨轉變為金剛石是吸熱反應B. 
紅磷比白磷穩定C. 
S(g)+O2(g)═SO2(g)ΔH1;S(s)+O2(g)═SO2(g)ΔH2,則ΔH1<ΔH2D. 
CO(g)+H2O(g)═CO2(g)+H2(g)ΔH>0組卷:3引用:2難度:0.5 -
4.已知:C(s)+O2(g)═CO2(g)ΔH1;
CO2(g)+C(s)═2CO(g)ΔH2;
2CO(g)+O2(g)═2CO2(g)ΔH3;
4Fe(s)+3O2(g)═2Fe2O3(s)ΔH4;
3CO(g)+Fe2O3(s)═3CO2(g)+2Fe(s)ΔH5
下列關于上述反應焓變的判斷正確的是( )A.ΔH1<0,ΔH3>0 B.ΔH2>0,ΔH4>0 C.ΔH1=ΔH2+ΔH3 D.ΔH3=ΔH4+ΔH5 組卷:169引用:6難度:0.7 -
5.強酸與強堿的稀溶液反應的熱化學方程式為H+(aq)+OH-(aq)═H2O(l) ΔH=-57.3 kJ?mol-1,向1 L 0.5 kJ?mol-1的NaOH溶液中加入下列物質:①稀醋酸、②濃硫酸、③稀硝酸,恰好完全反應的熱效應分別為ΔH1、ΔH2、ΔH3,三者的關系正確的是( )
A.ΔH1>ΔH2>ΔH3 B.ΔH1<ΔH3<ΔH2 C.ΔH1=ΔH3>ΔH2 D.ΔH1>ΔH3>ΔH2 組卷:19引用:2難度:0.7 -
6.已知斷裂1mol H2(g)中的H-H鍵需要吸收436.4KJ的能量,斷裂1mol O2(g)中的共價鍵需要吸收498KJ的能量,生成H2O(g)中的1mol H-O鍵能放出462.8KJ的能量。下列說法正確的是( )
A.斷裂1 mol H2O中的化學鍵需要吸收925.6 KJ的能量 B.2H2(g)+O2(g)═2H2O(g)△H=-480.4 KJ?mol-1 C.2H2O(l)═2H2(g)+O2(g)△H=471.6 KJ?mol-1 D.H2(g)+ O2(g)═H2O(l)△H=-240.2KJ?mol-112組卷:1495引用:5難度:0.7
二、非選擇題:
-
17.某探究小組用HNO3與大理石反應過程中質量減小的方法,研究影響反應速率的因素。所用HNO3濃度為1.00mol/L、2.00mol/L,大理石有細顆粒和粗顆粒兩種規格,實驗溫度為25℃、35℃,每次實驗HNO3的用量為25.00mL,大理石用量為10.00g。
(1)請完成以下實驗設計表,并在實驗目的一欄中填空:
(2)實驗①中CO2質量隨時間變化的關系如圖。計算實驗①中70s~90s范圍內用HNO3表示的平均反應速率實驗編號 溫度(℃) 大理石規格 HNO3濃度(mol/L) 實驗目的 ① 25 粗顆粒 2.00 (Ⅰ)實驗①和②探究濃度對反應速率的影響;
(Ⅱ)實驗①和③探究溫度對反應速率的影響;
(Ⅲ)實驗①和④探究對反應速率的影響② 25 粗顆粒
③
粗顆粒 2.00 ④
細顆粒
(忽略溶液體積變化,不需要寫出計算過程)。在0~70、70~90、90~200各不相同的時間段里,反應速率最大的時間段是。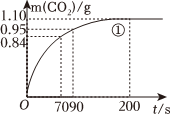 組卷:8引用:5難度:0.4
組卷:8引用:5難度:0.4 -
18.某小組利用H2C2O4溶液和硫酸酸化的KMnO4溶液反應來探究“外界條件對化學反應速率的影響”。實驗時通過測定酸性KMnO4溶液褪色所需時間來判斷反應的快慢。該小組設計了如下方案。已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2+8H2O。
(1)表中V1=實驗編號 0.1mol?L-1KMnO4溶液的體積/mL 0.6mol?L-1H2C2O4溶液的體積/mL H2O的體積/mL 實驗溫度/℃ 溶液褪色所需時間/min ① 10 V1 35 25 ② 10 10 30 25 ③ 10 10 V2 50 ,V2=。
(2)探究溫度對化學反應速率影響的實驗編號是(填編號,下同),探究反應物濃度對化學反應速率影響的實驗編號是。
(3)實驗①測得KMnO4溶液褪色所需時間為2min,忽略混合前后溶液體積的微小變化,這段時間內的平均反應速率v(H2C2O4)mol?L-1?min-1。組卷:4引用:2難度:0.7


