2019-2020學年四川省阿壩州九寨溝縣高二(上)期末化學試卷
發布:2024/4/20 14:35:0
一、單選題(10×6=60分)
-
1.下列元素基態原子的價電子排布式、電子排布式或電子排布圖不正確的是( )
A.Al 3s23p1 B.As[A r]4s24p3 C.Ar 3s23p6 D.Ni 3d84s2 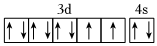 組卷:71引用:4難度:0.7
組卷:71引用:4難度:0.7 -
2.構造原理揭示的電子排布能級順序,實質是各能級能量高低順序.若以E表示某能級的能量,以下能量大小順序中正確的是( )
A.E(3s)>E(3p)>E(3d) B.E(3s)>E(2s)>E(1s) C.E(4f)<E(4s)<E(3d) D.E(5s)>E(4s)>E(4f) 組卷:355引用:11難度:0.5 -
3.下列說法正確的是( )
A.原子的第一電離能越大,該元素的電負性就越大 B.原子的電子層數越多,原子半徑越大 C.原子失去電子越多,說明其還原性越強 D.同一原子的能層越高,S電子云的半徑越大 組卷:14引用:1難度:0.6 -
4.關于CS2,SO2,NH3三種物質的說法中正確的是( )
A.CS2在水中的溶解度很小,是由于其屬于極性分子 B.SO2和NH3均易溶于水,原因之一是它們都是極性分子 C.CS2為非極性分子,所以在三種物質中熔、沸點最低 D.NH3在水中溶解度很大只是由于NH3分子有極性 組卷:41引用:11難度:0.8
二、填空題(每空2.5分,共40分)
-
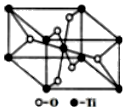 12.第四周期過渡元素Mn、Fe、Ti可與C、H、O形成多種化合物.
12.第四周期過渡元素Mn、Fe、Ti可與C、H、O形成多種化合物.
(1)H、C、O、N四種元素的電負性由小到大的順序為。
(2)Mn基態原子的電子排布式可表示為,CO32-的空間構型。(用文字表述)
(3)下列敘述正確的是。(填字母)
A.CH2O與水分子間能形成氫鍵
B.CH3COOH和苯分子中的碳原子均采用sp2雜化
C.CH2=CH-CHO分子中含有7個σ鍵和2個π鍵
D.CO的結構式可表示為:C=O
E.CO2晶體的熔點、沸點都比二氧化硅晶體的低
(4)在自然界中TiO2有金紅石、板鈦礦、銳鈦礦三種晶型,其中金紅石的晶胞如圖所示,則其中Ti4+的配位數為。組卷:4引用:1難度:0.5 -
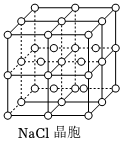 13.如圖所示,直線交點處的圓圈為NaCl晶體中Na+或Cl-所處的位置。這兩種離子在空間三個互相垂直的方向上都是等距離排列的。
13.如圖所示,直線交點處的圓圈為NaCl晶體中Na+或Cl-所處的位置。這兩種離子在空間三個互相垂直的方向上都是等距離排列的。
(1)在晶體中,每個Na+的周圍與它最接近且距離相等的Na+共有個。
(2)晶體中每一個重復的結構單元叫晶胞。在NaCl晶胞中正六面體的頂角上、面上、棱上的Na+或Cl-為該晶胞與其相鄰的晶胞所共有,一個晶胞中Cl-的個數等于,即(填計算式);Na+的個數等于,即。(填計算式)組卷:5引用:2難度:0.5


