2021-2022學年天津市耀華中學高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本題包括15小題,每小題3分,共45分。每小題只有一個選項符合題意。)
-
1.下列關于熱化學反應的描述中正確的是( )
A.已知H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ?mol-1,則H2SO4和Ba(OH)2反應的反應熱△H=-114.6kJ?mol-1 B.密閉容器中,9.6 g硫粉與11.2 g鐵粉混合加熱生成硫化亞鐵17.6 g時,放出19.12 kJ熱量,則Fe(s)+S(s)=FeS(s)△H=+95.6 kJ?mol-1 C.常溫時H2(g)的燃燒熱是285.8 kJ?mol-1,則2H2O(g)=2H2(g)+O2(g)△H=+571.6 kJ?mol-1 D.常溫時葡萄糖的燃燒熱是2800 kJ?mol-1,則1/2C6H12O6(s)+3O2(g)=3CO2(g)+3H2O( l )△H=-1400 kJ?mol-1 組卷:61引用:3難度:0.7 -
2.處于平衡狀態的反應2H2S(g)?2H2(g)+S2(g)△H>0,不改變其他條件的情況下合理的說法是( )
A.加入催化劑,反應途徑將發生改變,△H也將隨之改變 B.升高溫度,正逆反應速率都增大,H2S分解率也增大 C.增大壓強,平衡向逆反應方向移動,將引起體系溫度降低 D.若體系恒容,注人一些H2后達新平衡,H2濃度將減小 組卷:81引用:16難度:0.9 -
 3.在盛有足量A的體積可變的密閉容器中,加入B發生反應:A(s)+2B(g)?4C(g)+D(g),△H<0.在一定溫度、壓強下達到平衡。平衡時C的物質的量與加入的B的物質的量的變化關系如圖所示。下列說法正確的是( )
3.在盛有足量A的體積可變的密閉容器中,加入B發生反應:A(s)+2B(g)?4C(g)+D(g),△H<0.在一定溫度、壓強下達到平衡。平衡時C的物質的量與加入的B的物質的量的變化關系如圖所示。下列說法正確的是( )A.若保持壓強一定,當溫度升高后,則圖中θ>45° B.若再加入B,則再次達到平衡時正、逆反應速率均逐漸增大 C.若保持壓強一定,再加入B,則反應體系氣體密度減小 D.平衡時B的轉化率為50% 組卷:33引用:5難度:0.5 -
 4.在恒壓、NO和O2的起始濃度一定的條件下,催化反應相同時間,測得不同溫度下NO轉化為NO2的轉化率如圖中實線所示(圖中虛線表示相同條件下NO的平衡轉化率隨溫度的變化)。下列說法正確的是( )
4.在恒壓、NO和O2的起始濃度一定的條件下,催化反應相同時間,測得不同溫度下NO轉化為NO2的轉化率如圖中實線所示(圖中虛線表示相同條件下NO的平衡轉化率隨溫度的變化)。下列說法正確的是( )A.反應2NO(g)+O2(g)═2NO2(g)的ΔH>0 B.圖中X點所示條件下,延長反應時間不能提高NO轉化率 C.圖中Y點所示條件下,增加O2的濃度不能提高NO轉化率 D.380℃下,c起始(O2)=5.0×10-4mol?L-1,NO平衡轉化率為50%,則平衡常數K>2000 組卷:61引用:8難度:0.5 -
5.在容積不變的密閉容器中進行反應:2SO2(g)+O2(g)?2SO3(g)△H<0.下列各圖表示當其他條件不變時,改變某一條件對上述反應的影響,其中分析正確的是( )
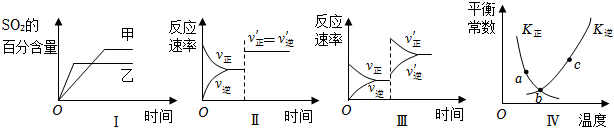
A.圖I表示溫度對化學平衡的影響,且甲的溫度較高 B.圖Ⅱ表示t0時刻使用催化劑對反應速率的影響 C.圖Ⅲ表示t0時刻增大O2的濃度對反應速率的影響 D.圖Ⅳ中a、b、c三點中只有b點已經達到化學平衡狀態 組卷:236引用:23難度:0.7 -
6.某溫度下,向2L恒容密閉容器中充入1.0mol A和1.0mol B,發生反應A(g)+B(g)?C(g),經過一段時間后反應達到平衡。反應過程中測定的部分數據見下表,下列說法正確的是( )
t/s 0 5 15 25 35 n(A)/mol 1.0 0.85 0.81 0.80 0.80 A.反應在前5s的平均速率v(A)=0.15mol/(L?s) B.保持其他條件不變,升高溫度,平衡時c(A)=0.41mol?L-1,則反應的△H>0 C.相同溫度下,起始時向容器中充入2.0mol C,達到平衡時,C的分解率大于80% D.相同溫度下,起始時向容器中充入0.20mol A、0.20mol B和1.0mol C,反應達到平衡前,v(正)<v(逆) 組卷:100引用:3難度:0.6
二、解答題(含7個小題,共55分)
-
19.研究氮氧化物與懸浮在大氣中海鹽粒子的相互作用時,涉及如下反應:
2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g) K1△H1<0 (Ⅰ)
2NO(g)+Cl2(g)?2ClNO(g) K2△H2<0 (Ⅱ)
(1)4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)的平衡常數K=(用K1、K2表示).
(2)為研究不同條件對反應(Ⅱ)的影響,在恒溫條件下,向2L恒容密閉容器中加入0.2mol NO和0.1mol
Cl2,10min時反應(Ⅱ)達到平衡.測得10min內v(ClNO)=7.5×10-3mol?L-1?min-1,則平衡后
n(Cl2)=mol,NO的轉化率α1=.其他條件保持不變,反應(Ⅱ)在恒壓條件下進行,平衡時NO的轉化率α2α1(填“>”“<”或“=”),平衡常數K2(填“增大”“減小”或“不變”).若要使K2減小,可采取的措施是.
(3)實驗室可用NaOH溶液吸收NO2,反應為2NO2+2NaOH═NaNO3+NaNO2+H2O.含0.2mol NaOH的水溶液與0.2mol NO2恰好完全反應得1L溶液A,溶液B為0.1mol?L-1的CH3COONa溶液,則兩溶液中c(NO)、-3
c(NO)和c(CH3COO-)由大到小的順序為-2.
(已知HNO2的電離常數Ka=7.1×10-4mol?L-1,CH3COOH的電離常數Ka=1.7×10-5mol?L-1)
可使溶液A和溶液B的pH相等的方法是.
a.向溶液A中加適量水 b.向溶液A中加適量NaOH
c.向溶液B中加適量水 d.向溶液B中加適量NaOH.組卷:409引用:40難度:0.5 -
20.天然氣的主要成分為CH4,一般還含有C2H6等烴類,是重要的燃料和化工原料。
(1)乙烷在一定條件可發生如下反應:C2H6(g)═C2H4(g)+H2(g)△H1,相關物質的燃燒熱數據如表所示。
①△H1=物質 C2H6(g) C2H4(g) H2(g) 燃燒熱△H/(kJ?mol-1) -1560 -1411 -286 kJ?mol-1。
②提高該反應平衡轉化率的方法有、。
③容器中通入等物質的量的乙烷和氫氣,在等壓下(p)發生上述反應,乙烷的平衡轉化率為α。反應的平衡常數Kp=(用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)。
(2)高溫下,甲烷生成乙烷的反應如下:2CH4C2H6+H2。反應在初期階段的速率方程為:v=k×cCH4,其中k為反應速率常數。高溫
①設反應開始時的反應速率為v1,甲烷的轉化率為α時的反應速率為v2,則v2=v1。
②對于處于初期階段的該反應,下列說法正確的是。
A.增加甲烷濃度,v增大
B.增加H2濃度,v增大
C.乙烷的生成速率逐漸增大
D.降低反應溫度,k減小組卷:61引用:3難度:0.6


