人教版(2019)選擇性必修1《第四單元 化學平衡》2023年單元測試卷(B卷)
發布:2024/8/16 14:0:1
一、選擇題
-
1.痛風病與關節滑液中形成的尿酸鈉有關(尿酸鈉增多,病情加重),其化學原理可表示為HUr(aq)+Na+(aq)?NaUr(s)+H+(aq)△H<0(HUr表示尿酸,NaUr表示尿酸鈉)。下列說法不正確的是( )
A.寒冷季節更易引發痛風病 B.大量飲水會增加痛風病發作的可能性 C.飲食中攝入過多食鹽,會加重痛風病病情 D.痛風病患者應少吃能代謝產生更多尿酸的食物 組卷:4引用:2難度:0.5 -
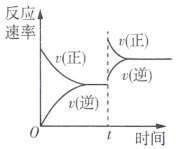 2.一定條件下在一恒容密閉容器中發生反應:N2(g)+3H2(g)?2NH3(g)△H<0,反應速率隨時間的變化情況如圖所示,t時僅改變某一條件,該條件可能是( )
2.一定條件下在一恒容密閉容器中發生反應:N2(g)+3H2(g)?2NH3(g)△H<0,反應速率隨時間的變化情況如圖所示,t時僅改變某一條件,該條件可能是( )A.加入適當催化劑 B.升高溫度 C.增大反應物的濃度 D.增大壓強 組卷:44引用:3難度:0.5 -
3.一定溫度下,將一定量氨基甲酸銨( NH2COONH4)置于某真空恒容密閉容器中,發生反應:NH2 COONH4(s)?2NH3(g)+CO2(g)。下列情況能說明該反應已達到化學平衡狀態的是( )
A.氣體的總質量保持不變 B.NH3和CO2的物質的量之比為2:1 C.v(NH3)=2v(CO2) D.混合氣體的平均相對分子質量不變 組卷:6引用:2難度:0.7 -
4.為探究濃度對化學平衡的影響,某同學進行如下實驗,下列說法不正確的是( )
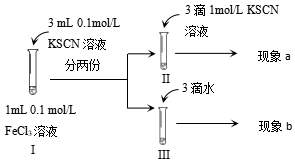
A.該實驗通過觀察顏色變化以判斷生成物濃度的變化 B.觀察到現象a比現象b中紅色更深,即可證明增加反應物濃度,平衡正向移動 C.進行Ⅱ、Ⅲ對比實驗的主要目的是防止由于溶液體積變化引起各離子濃度變化而干擾實驗結論得出 D.若Ⅰ中加入KSCN溶液的體積改為2mL也可以達到實驗目的 組卷:162引用:5難度:0.5 -
5.臭氧是理想的脫硝試劑,其脫硝時涉及的反應之一為O3(g)+2NO2(g)?N2O5(g)+O2(g)△H<0。若于恒容密閉容器中進行該反應,反應達到平衡狀態后,其他條件不變,只改變溫度(T)或壓強(p),下列圖象正確的是( )
A. 
B. 
C. 
D.  組卷:4引用:2難度:0.5
組卷:4引用:2難度:0.5 -
6.下列變化過程中說法不正確的是( )
A.已知2O3(g)=3O2(g)的△H<0、△S>0,則該反應在任何溫度下都能自發進行 B.“冰,水為之,而寒于水”說明相同質量的水和冰,水的能量高 C.干冰(CO2)升華過程中,△S>0 D.碳酸鈣在高溫下才能分解,因此碳酸鈣的分解反應不屬于自發反應 組卷:20引用:2難度:0.5
四、解答題
-
19.亞硝酰氯(NOCl)是有機合成中的重要試劑,可由NO和Cl2反應得到,化學方程式為2NO(g)+Cl2(g)?2NOCl(g)。
(1)氮氧化物與懸浮在大氣中的海鹽粒子相互作用時會生成亞硝酰氯,涉及如下反應:
①2NO2(g)+NaCl(s)?NaNO3(s)+NOCl(g)
②4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)
③2NO(g)+Cl2(g)?2NOCl(g)
設反應①②③對應的平衡常數依次為K1、K2、K3,則K1、K2、K3之間的關系為。
(2)300℃時,2NOCl(g)?2NO(g)+Cl2(g)。
正反應速率的表達式為v正=k?cn(NOCl)(k為速率常數,只與溫度有關),測得速率與濃度的關系如表所示:
n=序號 c(NOCl)/mol?L-1 v/mol?L-1?s-1 ① 0.30 3.60×10-9 ② 0.60 1.44×10-8 ③ 0.90 3.24×10-8 ,k=。
(3)在1L恒容密閉容器中充入2mol NO(g)和1mol Cl2(g),在不同溫度下測得c(NOCl)與時間t的關系如圖A所示:
反應開始到10min時NO的平均反應速率v(Cl2)=mol?L-1?min-1。
(4)在密閉容器中充入NO(g)和Cl2(g),改變外界條件[溫度、壓強、、與催化劑的接觸面積],NO的轉化率變化關系如圖B所示。X代表n(Cl2)n(NO)。組卷:19引用:3難度:0.5 -
20.三氧化鉬(MoO3)是石油工業中常用的催化劑,也是瓷軸藥的顏料,該物質常使用輝鉬礦(主要成分為MoS2)通過一定條件來制備。回答下列相關問題:
(1)已知:①MoS2(s)?Mo(s)+S2(g)ΔH1
②S2(g)+2O2(g)?2SO2(g)ΔH2
③2Mo(s)+3O2(g)?2MoO3(s)ΔH3
則2MoS2(s)+7O2(g)?2MoO3(s)+4SO2(g)的ΔH=(用含ΔH1、ΔH2、ΔH3的代數式表示)。
(2)若在恒溫恒容條件下,僅發生反應MoS2(s)?Mo(s)+S2(g)
①下列說法正確的是(填字母)。
a.氣體的密度不變,則反應一定達到了平衡狀態
b.氣體的相對分子質量不變,反應不一定處于平衡狀態
c.增加MoS2的量,平衡正向移動
②達到平衡時S2(g)的濃度為1.4mol?L-1,充入一定量的S2(g),反應再次達到平衡,S2(g)濃度(填“>”“<”或“=”)1.4mol?L-1。
(3)在2L恒容密閉容器中充入1.0mol S2(g)和1.5mol O2(g),若僅發生反應:S2(g)+2O2(g)?2SO2(g),5min后反應達到平衡,此時容器壓強為起始時的80%,則0~5min內,S2(g)的反應速率為mol?L-1?min-1。
(4)在恒容密閉容器中,加入足量的MoS2和O2,僅發生反應:2MoS2(s)+7O2(g)?2MoO3(s)+4SO2(g)ΔH.測得氧氣的平衡轉化率與起始壓強、溫度的關系如圖所示。
①ΔH(填“>”“<”或“=”)0;比較p1、p2、p3的大小:。
②若初始時通入7.0mol O2,P2為7.0kPa,則A點平衡常數Kp=(用氣體平衡分壓代替氣體平衡濃度計算,分壓=總壓×氣體的物質的量分數,寫出計算式即可)。壓強為p1,溫度為1100K時,平衡常數Kp′(填“>”“<”或“=”)Kp。組卷:105引用:10難度:0.4


