2021-2022學年上海市南洋模范中學高二(上)期中化學試卷(等級考)
發布:2024/4/20 14:35:0
一、選擇題(本題共40分)
-
1.下列物質中含有離子的是( )
A.鋁粉 B.金剛石 C.液態氯化氫 D.冰醋酸 組卷:16引用:3難度:0.8 -
2.測定膽礬晶體結晶水含量時,下列實驗操作一定會引起測定結果偏高的是( )
A.晶體未完全變白就停止加熱 B.加熱過程有晶體濺出 C.加熱后放在空氣中冷卻 D.坩堝壁上附有氯化鈉固體 組卷:16引用:2難度:0.7 -
3.關于元素周期表的說法正確的是( )
A.有16個主族 B.有3個短周期 C.主族都有非金屬元素 D.IA族全部是金屬元素 組卷:58引用:4難度:0.5 -
4.如圖表示1~18號元素(原子)的結構或性質隨核電荷數遞增的變化.該圖中,縱坐標表示( )
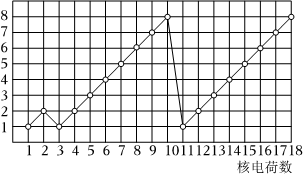
A.原子半徑 B.電子層數 C.最高化合價 D.最外層電子數 組卷:110引用:19難度:0.7 -
5.下列化合物不能通過置換反應制取的是( )
A.FeSO4 B.Al2O3 C.Fe3O4 D.Fe(OH)3 組卷:4引用:2難度:0.8 -
6.可證明Fe3+具有氧化性的微粒是( )
①SCN-;②Fe;③Fe2+;④H2S;⑤OH-A.①② B.④⑤ C.②③ D.②④ 組卷:24引用:3難度:0.7 -
 7.用除去表面氧化膜的細鋁條緊緊纏繞在溫度計上(如圖),將少許硝酸汞溶液滴到鋁條表面,置于空氣中,很快鋁條表面產生“白毛”,且溫度明顯上升.下列分析錯誤的是( )
7.用除去表面氧化膜的細鋁條緊緊纏繞在溫度計上(如圖),將少許硝酸汞溶液滴到鋁條表面,置于空氣中,很快鋁條表面產生“白毛”,且溫度明顯上升.下列分析錯誤的是( )A.Al和O2化合放出熱量 B.硝酸汞是催化劑 C.涉及了:2Al+3Hg2+→2Al3++3Hg D.“白毛”是氧化鋁 組卷:226引用:8難度:0.7 -
8.同一短周期的X、Y、Z三種元素,其最高價氧化物對應的水化物呈酸性,酸性強弱為HXO4>H2YO4>H3ZO4,則下列判斷正確的是( )
A.原子半徑:X>Y>Z B.非金屬性:X>Y>Z C.氣態氫化物穩定性:HX<H2Y<ZH3 D.最低價態的陰離子還原性:X->Y2->Z3- 組卷:29引用:4難度:0.9
二、綜合題(共60分)
-
23.氯化鐵、硫酸鐵和摩爾鹽是鐵的三種重要鹽類,在凈水和定量分析等方面具有重要作用。
(1)配制FeCl3溶液時,應先將一定質量的FeCl3固體溶于,再進行后續操作。除去FeCl3溶液中含少量的FeCl2溶液,應通入氯氣,相關離子方程式為。
(2)用FeCl3溶液腐蝕印刷電路板上的銅,向所得溶液中加入鐵粉,對加入鐵粉充分反應后的溶液分析合理的是。
a.若無固體剩余,則溶液中一定有Ee3+
b.若有固體存在,則溶液中一定有Fe2+
c.若溶液中有Cu2+,則一定沒有固體析出
d.若溶液中有Fe2+,則一定有Cu析出
(3)摩爾鹽[(NH4)2Fe(SO4)2?6H2O]在定量分析中常作為基準物質,用來標定重鉻酸鉀、高錳酸鉀等溶液的濃度,在0.1mol?L-1的該鹽的溶液中,陽離子濃度由大到小的順序是。
(4)Fe2(SO4)3溶液可除去煤中以黃鐵礦(FeS2)形式存在的硫元素,反應如下(未配平):FeS2+Fe2(SO4)3+H2O→FeSO4+H2SO4。檢驗Fe(SO4)3溶液已消耗完的方法.該方法的優點之一是Fe2(SO4)3易再生。向反應后的溶液中通入氣體,就能達到使Fe2(SO4)3再生的目的,方便且價廉。組卷:61引用:2難度:0.4 -
24.某化學小組設計以下實驗方案,測定某含有NaCl的小蘇打樣品中NaHCO的質量分數。
[方案一]查資料:NaCl加熱至801℃時熔化而不分解:稱取5.000g樣品,置于坩堝中用酒精燈加熱(溫度不超過800℃)至恒重后,冷卻,稱量剩余固體質量為3.450g。[已知NaHCO3加熱分解生成Na2CO3、CO2和H2O]
(1)實驗中,恒重的標準是。
(2)計算樣品中NaHCO3的質量g。(結果保留到小數點后三位)
[方案二]準確稱取1.000g樣品,用容量瓶配成100mL溶液,用滴定管量取20.00mL至錐形瓶中,加入2滴甲基橙為指示劑,用0.1000mol?L-1鹽酸標準溶液滴定。3次實驗的數據如下:
(3)終點時溶液由滴定次數
實驗數據1 2 3 V(樣品)/mL 20.00 20.00 20.00 V (鹽酸)/mL(初始) 0.00 0.10 0.20 V (鹽酸)/mL(終點) 19.98 22.10 20.22 色變為色,且半分鐘顏色不再變化。
(4)樣品中NaHCO3的質量分數為。下列操作導致實驗結果偏高的是。
a.錐形瓶用待測液潤洗
b.滴定管未用待測液潤洗即裝入待測液后量取待測液
c.振蕩錐形瓶時有少量液體濺出
d.滴定過程中用少量水沖洗錐形瓶內壁
[方案三]稱取一定質量樣品,置于小燒杯中,加適量水溶解:向小燒杯中加入足量澄清石灰水,過濾,洗滌、干燥沉淀,稱量沉淀的質量,計算。
(5)檢驗沉淀已完全的方法是。
(6)有同學提出用Ba(OH)2溶液代替石灰水更好,其理由是。組卷:4引用:2難度:0.5


