2022-2023學年安徽省六校教育研究會高一(上)入學化學試卷
發布:2024/9/6 2:0:8
一、單項選擇題(包括12題,每題2分,共24分,每題只有一個選項符合題意)
-
1.將下列物質加入水中充分攪拌,能形成無色溶液的是( )
A.面粉 B.硫酸銅 C.酒精 D.植物油 組卷:49引用:3難度:0.9 -
2.
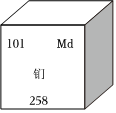 為紀念元素周期表的發現者門捷列夫,1955年發現的一種新元素命名為“鍆”,其在元素周期表中的有關信息如圖所示,有關鍆的說法錯誤的是( )
為紀念元素周期表的發現者門捷列夫,1955年發現的一種新元素命名為“鍆”,其在元素周期表中的有關信息如圖所示,有關鍆的說法錯誤的是( )A.屬于金屬元素 B.元素符號是Md C.原子序數是101 D.相對原子質量是258g 組卷:4引用:2難度:0.5 -
3.科學家最新發現,通過簡單的化學反應,可以將樹木纖維素轉變成超級儲能裝置,如圖是該反應的微觀示意圖,下列說法錯誤的是( )
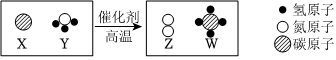
A.反應前后不變的微粒是碳、氫和氫原子 B.生成物Z和W的質量比為7:4 C.該化學反應為置換反應 D.W是最簡單的有機化合物 組卷:1引用:2難度:0.8 -
4.下列除雜質(括號內為雜質)的實驗設計中,所選試劑和操作都正確的是( )
選項 物質 選用試劑 操作 A CO2(HCl) NaOH溶液 將混合氣體通過NaOH溶液 B KClO3固體(KCl) / 加熱至不再產生氣體 C KNO3溶液(KOH) CuSO4溶液 加入適量試劑,過濾、蒸發 D MgCl2溶液(NaCl) ①KOH溶液
②稀鹽酸加入過量試劑①,過濾、洗滌,向所得固體中加入適量試劑②至固體恰好溶解 A.A B.B C.C D.D 組卷:0引用:2難度:0.7 -
5.某同學將一小包銅粉和鋅粉的混合物放入一定量的硝酸銀溶液中,使其充分反應后過濾,得到固體和藍色濾液。下列有關判斷正確的是( )
A.濾渣中一定有銀,沒有銅和鋅 B.濾液中一定有硝酸鋅、硝酸銅,可能有硝酸銀 C.濾液中一定有硝酸鋅、硝酸銅、硝酸銀 D.濾渣中一定有銀和鋅,可能有銅 組卷:5引用:2難度:0.7
二、非選擇題
-
16.某學習小組對鐵銹蝕進行探究。
【提出問題】鐵銹蝕與哪些因素有關?
【查閱資料】1.氯化鈣固體可作干燥劑。
2.碳粉可加快鐵的銹蝕,碳粉不與鹽酸反應。
3.常溫常壓,氫氣密度是dg/mL。
4.鐵銹與鹽酸反應不產生氣體。
【設計與實驗】
實驗一:定性探究鐵銹蝕的因素
取四枚相同的潔凈無銹鐵釘分別放入試管,進行圖1實驗,現象如表。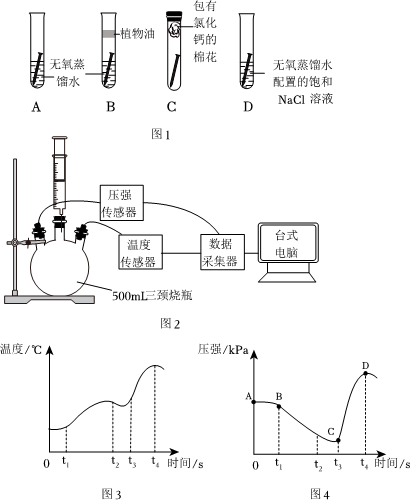
(1)對比A、B、C試管中實驗現象,說明鐵銹蝕是與空氣中的試管 一周后現象 A 鐵釘表面有一層鐵銹 B 鐵釘表面無明顯變化 C 鐵釘表面無明顯變化 D 鐵釘表面有較厚鐵銹 、發生化學反應。
(2)對比和D試管中實驗現象,說明鐵銹蝕快慢與有關。
(3)得到無氧蒸餾水可采用煮沸的方法,是因為氧氣在水中的溶解度隨溫度的升高而(填“升高”或“降低”)。
實驗二:定量探究影響鐵銹蝕的因素
小組設計了圖2裝置,檢查氣密性,將5g鐵粉和2g碳粉加入三頸燒瓶,t1時刻加入2mL飽和NaCl溶液后,再將一只裝有5mL稀鹽酸(鹽酸有揮發性)的注射器插到燒瓶上(此時沒有推動注射器活塞),采集數據。
(4)據圖3,說明鐵生銹是(填“放熱”或“吸熱”)過程,t2~t3這段時間反應并未停止,溫度卻開始降低,原因是。
(5)據圖4,分析t3時刻后壓強突然變大的原因是。組卷:11引用:2難度:0.7 -
17.為測定某化工廠排放的廢水中CuSO4的含量,化學小組同學取150g廢水,平均分為三份,每一份樣品均按如圖所示裝置進行實驗,實驗數據記錄如下表:

試分析并計算:實驗1 實驗2 實驗3 樣品質量/g 50 50 50 NaOH溶液質量/g 20 40 60 m/g 44.9 49.8 49.8
(1)50g廢水完全反應時,所得沉淀的質量為g。
(2)計算該化工廠廢水中CuSO4溶液的質量分數。組卷:4引用:2難度:0.8


