2021-2022學年陜西省漢中中學高二(上)第三次月考化學試卷
發布:2024/9/13 10:0:8
一、選擇題(每題只有一個選項符合題意,共16小題,共48分)
-
1.下列應用與鹽類水解無主要關系的是( )
A.用鋁鹽和鐵鹽作凈水劑 B.將SOCl2(遇水劇烈水解)和AlCl3?6H2O混合加熱制取無水AlCl3 C.FeSO4溶液制備FeSO4?7H2O晶體時,不能直接蒸干結晶獲取 D.草木灰與銨態氮肥不能混合施用 組卷:151引用:13難度:0.7 -
2.對H2O的電離平衡不產生影響的粒子是( )
A. 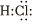
B.26Fe3+ C. 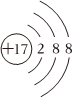
D. 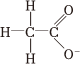 組卷:73引用:20難度:0.7
組卷:73引用:20難度:0.7 -
3.如圖實驗操作能達到實驗目的的是( )
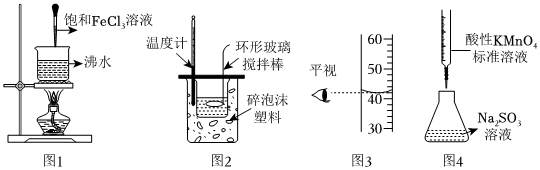
A.圖1可制得氫氧化鐵膠體 B.圖2可用來測定中和反應的反應熱 C.圖3的讀數為42.00mL D.圖4可用標準酸性高錳酸鉀溶液測定未知Na2SO3溶液的濃度 組卷:16引用:5難度:0.5 -
4.10mL濃度為1mol/L的鹽酸和過量的鋅反應,為加快反應速率,又不影響生成氫氣的總量,可采用的方法是( )
A.再加入10mL濃度為0.5mol/L的硫酸 B.加入幾滴CuCl2溶液 C.加入幾滴NaNO3溶液 D.加入少量CH3COONa溶液 組卷:70引用:7難度:0.8 -
5.下列描述的化學反應狀態,不一定是平衡狀態的是( )
A.3H2(g)+N2(g)?2NH3(g)反應體系中H2與N2的物質的量之比保持3:1 B.2NO2(g)?N2O4(g)恒溫、恒容下,反應體系中氣體的壓強保持不變 C.CaCO3(s)?O2(g)+CaO(s)恒溫、恒容下,反應體系中氣體的密度保持不變 D.H2(g)+Br2(g)?2HBr(g)恒溫、恒容下,反應體系中氣體的顏色保持不變 組卷:26引用:3難度:0.6 -
 6.在t℃時,AgBr在水中的沉淀溶解平衡曲線如圖所示。已知t℃時AgCl的Ksp=4×10-10,下列說法正確的是( )
6.在t℃時,AgBr在水中的沉淀溶解平衡曲線如圖所示。已知t℃時AgCl的Ksp=4×10-10,下列說法正確的是( )A.圖中a點對應的體系中將有AgBr沉淀生成 B.加入NaBr固體,AgBr的溶解度減小,AgBr的Ksp也減小 C.在AgBr飽和溶液中加入固體NaBr,可使溶液中c點變到b點 D.在t℃時,AgCl(s)+Br-(aq)?AgBr(s)+Cl-(aq)的平衡常數K≈816 組卷:28引用:3難度:0.6
二、非選擇題:包括第17題~第20題4個大題,共52分。
-
19.吸收工廠煙氣中的SO2,能有效減少SO2對空氣的污染。氨水、ZnO水懸濁液吸收煙氣中SO2后經O2催化氧化,可得到硫酸鹽。

已知:室溫下,ZnSO3微溶于水,Zn(HSO3)2易溶于水;溶液中H2SO3、、HSO-3的物質的量分數隨pH的分布如圖1所示。SO2-3
(1)氨水吸收SO2.向氨水中通入少量SO2,主要反應的離子方程式為;當通入SO2至溶液pH=6時,溶液中濃度最大的陰離子是(填化學式)。
(2)ZnO水懸濁液吸收SO2.向ZnO水懸濁液中勻速緩慢通入SO2,在開始吸收的40min內,SO2吸收率、溶液pH均經歷了從幾乎不變到迅速降低的變化(如圖2)。溶液pH幾乎不變階段,主要產物是( 填化學式);SO2吸收率迅速降低階段,主要反應的離子方程式為。
(3)O2催化氧化。其他條件相同時,調節吸收SO2得到溶液的pH在4.5~6.5范圍內,pH越低生成速率越大,其主要原因是SO2-4;隨著氧化的進行,溶液的pH將(填“增大”、“減小”或“不變“)。組卷:876引用:4難度:0.5 -
20.氫氣是一種清潔高效的新型能源,如何經濟實用的制取氫氣成為重要課題。
(1)硫碘循環分解水是一種高效、環保的制氫方法,其流程圖如圖。
已知:
反應Ⅱ:H2SO4(aq)═SO2(g)+H2O(l)+O2(g)ΔH2=+327kJ?mol-112
反應Ⅲ:2HI(aq)═H2(g)+I2(g)ΔH3=+172kJ?mol-1
反應2H2O(l)═2H2(g)+O2(g)ΔH=+572kJ?mol-1
則反應Ⅰ的熱化學方程式為。
(2)H2S可用于高效制取氫氣,發生的反應為2H2S(g)?S2(g)+2H2(g)。
Ⅰ.若起始時容器中只有H2S,平衡時三種物質的物質的量與裂解溫度的關系如圖1。
①圖中曲線Z表示的物質是。(填化學式)
②C點時H2S的轉化率為%。(保留一位小數)
③A點時,設容器內的總壓為pPa,則平衡常數Kp=。(用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)
Ⅱ.若在兩個等體積的恒容容器中分別加入2.0mol H2S、1.0mol H2S,測得不同溫度下H2S的平衡轉化率如圖2所示。
①M點、O點和N點的逆反應速率v(M)、v(O)和v(N)的大小關系為。(用“>”“<”或“=”表示,下同)
②M、N兩點容器內的壓強2p(M)p(N),平衡常數K(M)、K(N)、K(O)三者的大小關系為。組卷:27引用:5難度:0.4


