2022-2023學年遼寧省沈陽二中高三(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題:(每題只有一個正確選項,每題3分)
-
1.化學與社會、生產、生活和科技都密切相關。下列有關說法正確的是( )
A.“天宮二號”使用的碳纖維,是一種新型有機高分子材料 B.利用化石燃料燃燒產生的CO2合成聚碳酸酯可降解塑料,有利于實現“碳中和” C.阿司匹林可用于治療胃酸過多,碘酸鉀可用作營養強化劑 D.二氧化氯泡騰片和酒精可殺滅新型冠狀病毒,二者消毒時均表現為強氧化性 組卷:32引用:3難度:0.7 -
2.下列有關描述及化學用語的表示方法正確的是( )
A.As原子的簡化電子排布式為[Ar]3s23p3 B.KCl形成過程: 
C.基態Mg原子的核外電子排布圖為 
D.Se在周期中屬于p區元素,Zn屬開ds區元素 組卷:38引用:3難度:0.6 -
3.NA為阿伏加德羅常數的值,下列說法正確的是( )
A.1molD318O+(其中D代表H)中含有的中子數為10NA B.用1L1.0mol/LFeCl3溶液制備氫氧化鐵膠體,所得氫氧化鐵膠粒的數目可能為2NA C.34g 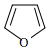 中含有的極性鍵數目為3NA
中含有的極性鍵數目為3NAD.用濃鹽酸分別和MnO2、KClO3反應制1mol氯氣,轉移的電子數均為2NA 組卷:10引用:1難度:0.7 -
4.下列離子反應方程式書寫正確的是( )
A.CuSO4與過量濃氨水反應的離子方程式:Cu2++2NH3?H2O=Cu(OH)2+2NH4+ B.惰性電極電解氯化鎂溶液:2Cl-+2H2O H2↑+Cl2↑+2OH-通電C.向Mg(HCO3)2溶液中加入過量NaOH溶液,產生白色沉淀:Mg2++2HCO3-+2OH-=MgCO3+CO32-+2H2O D.向 NH4Fe(SO4)2溶液中加入少量Ba(OH)2溶液:2Fe3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Fe(OH)3↓ 組卷:17引用:1難度:0.7 -
5.下列說法正確的一組是( )
①按照純凈物、混合物、強電解質、弱電解質和非電解質順序排列的是CuSO4?5H2O、漂白粉、苛性鈉、次氯酸、氨氣
②電解質溶液導電的原因是電解質在外界電源的作用下電離出能自由移動的陰陽離子
③NH3鍵角比PH3的大,是因為NH3的成鍵電子對間排斥力較大
④由于離子鍵作用力很強,所以離子晶體的熔點都很高
⑤馬口鐵《鍍錫鐵》表面出現破損時,腐蝕速率會加快
⑥電解精煉銅,陽極為純銅,陰極為粗銅
⑦Na與HCl反應是放熱反應,而NaHCO3與HCl反應是吸熱反應
⑧電解硫酸銅溶液一段時間后,向電解后的溶液中加入Cu(OH)2固體,溶液能快復到原來濃度A.①③⑤⑧ B.②④⑥⑦ C.①③⑤⑦ D.②③⑤⑧ 組卷:21引用:1難度:0.7 -
6.下列有關實驗裝置進行的相應實驗,能達到實驗目的的是( )

A.利用圖1裝置可從氯化鐵溶液中直接蒸發結晶獲得氯化鐵晶體 B.利用圖2裝置可分離石油,得到汽油、煤油和柴油等各種餾分 C.利用圖3裝置可分離飽和Na2CO3溶液和CH3COOC2H5 D.利用圖2和圖3可進行粗鹽提純 組卷:14引用:2難度:0.6
二、填空題
-
18.硫氰化鉀(KSCN)俗稱玫瑰紅酸鉀,是一種用途廣泛的化學藥品。實驗室模擬工業制備硫氰化鉀的實驗裝置如圖所示:

已知:①CS2不溶于水,密度比水的大;②NH3不溶于CS2;③硫氰化鉀熔點172℃;④三頸燒瓶內盛放有CS2、水和催化劑。回答下列問題:
Ⅰ.制餐NH4SCN溶液
(1)實驗前,檢查裝置氣密性良好后,裝入藥品。裝置B中的試劑是;三頸燒瓶的下層CS2液體必須浸沒導氣管口,目的是。
(2)實驗開始時,打開K1,加熱裝置A、D.將A中產生的氣體緩緩通入D中,發生反應CS2+3NH3NH4SCN+NH4HS(該反應比較緩慢),當看到催化劑水浴加熱現象時說明該反應接近完全。
Ⅱ.制備KSCN溶液
(3)熄滅A處的酒精燈,關閉K1,移開水浴,將裝置D維續加熱至105℃,當NH4HS完全分解后(NH4HSH2S↑+NH3↑),打開K2,繼續保持液溫105℃,緩緩滴入適量的KOH溶液,發生反應的化學方程式為加熱。
(4)裝置E可用于處理尾氣,多孔球泡的作用是:。已知酸性重鉻酸鉀溶液能將H2S氧化生成淺黃色沉淀,鉻元素被還原為Cr3+,寫出其氧化H2S的離子方程式。
Ⅲ.制備KSCN晶體
(5)先濾去三頸燒瓶中的固體催化劑,再在減壓條件下,、過濾、洗滌、干燥,得到硫氰化鉀晶體。組卷:17引用:1難度:0.5 -
19.工業上可利用煉鋅礦渣(主要含鐵酸Ga2(Fe2O4)3、鐵酸鋅ZnFe2O4)獲得3種金屬鹽,并進一步利用鎵鹽例制備具有優異光電性能的氮化鎵(GaN),部分工藝流程如圖1:

已知:①常溫下,浸出液中各離子的濃度及其開始形成氫氧化物沉淀的pH與金屬離子在該工藝條件下的萃取率(進入有機層中金屬離子的百分數)如表。
②與鋁的化學性質相似。
③當溶液中剩余離子的濃度小于10-5mol/L時,視為沉淀完全。
回答下列問題:金屬離子 Fe2+ Fe3+ Zn2+ Ga3+ 開始沉淀pH 8.0 1.7 5.5 3.0 沉淀完全pH 9.6 3.2 8.0 4.9 萃取率(%) 0 99 0 97~98.5
(1)Ga2(Fe2O4)3中Ga的化合價為,“浸出”時其發生反應的離子方程式為。
(2)濾餅的主要成分是,萃取前加入的固體X為。
(3)電解過程包括電解反萃取液制粗鎵和粗鎵精煉兩個步驟。寫出第一步電解產生粗鎵的電極反應式:。
(4)GaN可采用MOCVD(金屬有機物化學氣相淀積)技術制得:以“合成”步驟中產生的三甲基鎵(Ga(CH3)3)為原料,使其與NH3發生系列反應得到GaN和另一種產物,該過程的化學方程式為。
(5)由濾液可制備ZnC2O4?2H2O,再通過熱分解探究其產物,已知ZnC2O4?2H2O(M=189)的TG-DTA(熱重分析一差熱分析)曲線如圖所示。(熱流:是指反應過程中,單位時間內通過反應體系傳遞的熱量)
則ZnC2O4?2H2O分解是反應(填“放熱”或“吸熱”),分解的總化學方程式為。組卷:14引用:1難度:0.9


