2021-2022學年天津市兩校聯考高二(上)第二次質檢化學試卷
發布:2024/11/9 19:30:2
一、單選題(60分)
-
1.下列關于反應熱的敘述正確的是( )
A.當△H<0時,表示該反應為吸熱反應 B.由C(s)+ O2(g)═CO(g)的反應熱為110.5 kJ?mol-1,可知碳的燃燒熱為110.5 kJ?mol-112C.反應熱的大小與反應物所具有的能量和生成物所具有的能量無關 D.1 mol NaOH分別和1 mol CH3COOH、1 mol HNO3反應放出的熱量:CH3COOH<HNO3 組卷:17引用:6難度:0.6 -
2.已知:2CO(g)+O2(g)═2CO2(g) ΔH=-566kJ?mol-1
2Na2O2(s)+2CO2(g)═2Na2CO3(s)+O2(g) ΔH=-452kJ?mol-1。
根據以上熱化學方程式,判斷下列說法正確的是( )A.1molCO完全燃燒,放出熱量為283J B.Na2O2(s)+CO2(g)═Na2CO3(s)+ O2(g) ΔH=-226kJ?mol-112C.CO(g)與Na2O2(s)反應放出509kJ熱量時,電子轉移數為1.204×1024 D.CO的燃燒熱為-283kJ 組卷:9引用:1難度:0.6 -
3.用鐵片與稀硫酸反應制取氫氣時,下列措施不能使氫氣生成速率加大的是( )
A.對該反應體系加熱 B.不用稀硫酸,改用98%的濃硫酸 C.向H2SO4中通入HCl氣體 D.不用鐵片,改用鐵粉 組卷:52引用:7難度:0.5 -
4.下列事實不能用勒夏特列原理解釋的是( )
A.光照新制的氯水時,溶液的pH逐漸減小 B.加催化劑,使N2和H2在一定條件下轉化為NH3 C.可用濃氨水和氫氧化鈉固體快速制取氨氣 D.增大壓強,有利于SO2與O2反應生成SO3 組卷:14引用:3難度:0.6 -
5.恒溫恒容的情況下,反應A2(g)+B2(g)?2AB(g)達到平衡狀態的標志 是( )
A.容器內氣體的密度不隨時間而變化 B.容器內的總壓強不隨時間而變化 C.單位時間內生成2nmol AB的同時,生成nmol的B2 D.A2、B2、AB的反應速率比為1:1:2的狀態 組卷:47引用:8難度:0.9 -
6.在一密閉容器中,反應aA(g)?bB(g)達平衡后,測得B的濃度為0.5mol?L-1,保持溫度不變,將容器體積增加一倍,當達到新的平衡時,B的濃度變為0.3mol?L-1,則下列說法正確的是( )
A.平衡向逆反應方向移動了 B.物質A的轉化率減少了 C.物質B的質量分數增大了 D.a>b 組卷:6引用:1難度:0.7 -
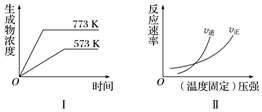 7.有下列兩個圖象,下列反應中同時符合兩圖象的是( )
7.有下列兩個圖象,下列反應中同時符合兩圖象的是( )A.N2(g)+3H2(g)?2NH3(g) ΔH<0 B.2SO3(g)?2SO2(g)+O2(g) ΔH>0 C.4NH3(g)+5O2(g)?4NO(g)+6H2O(g) ΔH<0 D.A2(g)+2B2(g)?C2(g) ΔH>0 組卷:17引用:1難度:0.7 -
8.硫酸是一種重要的化工產品,硫酸的消耗量常被視為一個國家工業發達水平的一種標志.目前的重要生產方法是“接觸法”,有關接觸氧化反應:2SO2+O2
2SO3的說法不正確的是( )催化劑△A.該反應為可逆反應,故在一定條件下SO2和O2不可能全部轉化為SO3 B.達到平衡后,反應就停止了,故正、逆反應速率相等且均為零 C.一定條件下,向某密閉容器中加入2 mol SO2和1 mol O2,則從反應開始到平衡的過程中,正反應速率不斷減小,逆反應速率不斷增大,某一時刻,正、逆反應速率相等 D.在利用上述反應生產SO3時,要同時考慮反應所能達到的限度和化學反應速率兩方面的問題 組卷:281引用:13難度:0.9
二、非選擇題
-
23.某溫度時,在一個容積為2L的密閉容器中,X、Y、Z三種物質的物質的量隨時間的變化曲線如圖所示。根據圖1中數據,填寫下列空白。
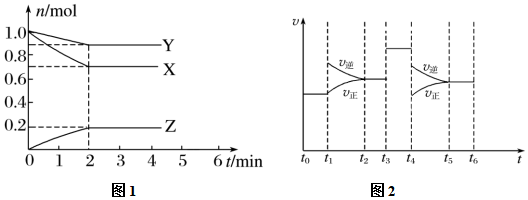
(1)該反應的化學方程式為。
(2)反應開始至2 min,氣體Z的平均反應速率v(Z)=。
(3)若X、Y、Z均為氣體,反應達到平衡時:
①平衡常數表達式為;
②X的轉化率為。
(4)上述反應在t1~t6內反應速率與時間圖象如圖2所示,①達到平衡的時間段為;②在每一時刻均改變一個影響反應速率的因素,則下列說法正確的是(填字母)。
A.在t1時增大了壓強
B.在t3時加入催化劑
C.在t4時降低了溫度
D.t2~t3時X的轉化率最高組卷:1引用:1難度:0.7 -
24.用酸堿中和滴定法測定某燒堿樣品的純度,試根據實驗回答下列問題:
(1)準確稱量8.2g含有少量中性易溶雜質的樣品,配成500mL待測溶液。稱量時,樣品可放在(填字母)稱量。
a.小燒杯中
b.潔凈紙片上
c.托盤上
(2)滴定時,用0.2000mol?L-1的鹽酸來滴定待測溶液,不可選用(填字母)作指示劑。
A.酚酞
B.石蕊
C、甲基橙
(3)滴定過程中,眼睛應注視;
(4)根據如表數據,計算被測燒堿溶液的物質的量濃度是(保留兩位小數)
(5)下列操作能使測定結果填(偏高、偏低或無影響)滴定次數 待測溶液體積/mL 標準酸溶液體積 滴定前的刻度/mL 滴定后的刻度/mL 第一次 10.00 0.40 20.50 第二次 10.00 4.10 24.00
①滴定管沒有用標準液潤洗。
②錐形瓶水洗后沒有干燥。
③滴定前仰視滴定管刻度,滴定后俯視。組卷:20引用:1難度:0.8


