2021-2022學年湖北省孝感市高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題:本大題共15小題,每小題只有一個選項符合題意,每小題3分,共45分。
-
1.下列說法正確的是( )
A.吸熱反應在常溫下一定不能發生 B.需要加熱才能發生的反應一定是吸熱反應 C.在水煤氣燃燒的反應中,化學能只轉化為熱能 D.舊化學鍵斷裂吸收的能量與新化學鍵形成所釋放的能量的相對大小決定了反應是放熱還是吸熱 組卷:2引用:1難度:0.6 -
2.對于化學反應方向的確定不僅與焓變(△H)有關,也與溫度(T)、熵變(△S)有關,實驗證明,化學反應的方向應由△H-T△S確定,若△H-T△S<0,則自發進行,否則不能自發進行。下列說法中正確的是( )
A.反應焓變是決定反應能否自發進行的唯一因素 B.溫度、壓強一定時,熵增加的反應一定能自發進行 C.在溫度、壓強一定的條件下,焓因素和熵因素共同決定一個化學反應的方向 D.固體的溶解過程只與焓變有關 組卷:11引用:2難度:0.7 -
3.為探究鋅與稀硫酸反應生成氫氣的速率用[v(H2)來表示],向反應混合液中加入某些物質,下列判斷正確的是( )
A.加入NaHSO4固體,v(H2)不變 B.加入少量水,v(H2)減小 C.加入Na2SO4固體,v(H2)減小 D.滴加少量HNO3溶液,v(H2)增大 組卷:49引用:5難度:0.8 -
4.下列物質的工業生產過程中,不涉及勒夏特列原理的是( )
A.合成氨 B.制硫酸 C.制氯化氫 D.制純堿 組卷:56引用:3難度:0.5 -
5.鎢絲燈管中的W在使用過程中緩慢揮發,使燈絲變細,加入I2可延長燈管的使用壽命,其工作原理為:W(s)+2I2(g)
WI4(g)。下列說法不正確的是( )1400℃約3000℃A.燈管內的I2可循環使用 B.WI4在燈絲上分解,產生的W又沉積在燈絲上 C.溫度升高時,WI4的分解速率加快,W和I2的化合速率減慢 D.利用該反應可以提純W 組卷:54引用:3難度:0.7 -
6.恒溫恒容條件下,某密閉容器中發生如下反應:H2(g)+I2(g)?2HI(g),說明該反應已達到平衡狀態的是( )
A.容器內總壓強不隨時間改變 B.氣體的密度不隨時間改變 C.單位時間內生成2molHI同時消耗1molH2 D.H2的體積分數不隨時間改變 組卷:8引用:1難度:0.7
二、非選擇題:本大題共5小題,共55分。
-
19.(1)對煙道氣中的SO2進行回收再利用具有較高的社會價值和經濟價值。
CO還原法:一定條件下,由SO2和CO反應生成S和CO2的能量變化如圖所示,每生成16gS(s),該反應(填“放出”或“吸收”)的熱量為。該反應的熱化學方程式為。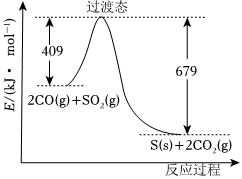
(2)汽車尾氣中排放的NOx和CO污染環境,在汽車尾氣系統中裝置催化轉化器,可有效降低NOx和CO的排放.已知:
①2CO(g)+O2(g)?2CO2(g)ΔH=-566.0kJ?mol-1
②N2(g)+O2(g)?2NO(g)ΔH=+180.5kJ?mol-1
③2NO(g)+O2(g)?2NO2(g)ΔH=-116.5kJ?mol-1
Ⅰ.CO的燃燒熱為。若1mol N2(g)、1mol O2(g)分子中化學鍵斷裂時分別需要吸收946kJ、498kJ的能量,則1mol NO(g)分子中化學鍵斷裂時需吸收的能量為kJ。
Ⅱ.CO將NO2還原為單質的熱化學方程式為。組卷:21引用:3難度:0.7 -
20.氮是地球上含量豐富的一種元素,氮及其化合物在工農業生產、生活中有著重要作用,合成氨工業在國民生產中有重要意義。以下是關于合成氨的有關問題,請回答:
(1)若在一容積為2L的密閉容器中加入0.2mol的N2和0.6mol的H2在一定條件下發生反應:N2(g)+3H2(g)?2NH3(g)△H<0,若在5分鐘時反應達到平衡,此時測得H2的轉化率為50%。則前5分鐘的平均反應速率v(N2)=。
(2)平衡后,若提高H2的轉化率,可以采取的措施有。
A.加了催化劑
B.增大容器體積
C.降低反應體系的溫度
D.加入一定量N2
(3)若在0.5L的密閉容器中,一定量的氮氣和氫氣進行如下反應:N2(g)+3H2(g)?2NH3(g)△H<0,其化學平衡常數K與溫度T的關系如表所示:
①試比較K1、K2的大小,K1T/℃ 200 300 400 K K1 K2 0.5 K2(填“<”、“>”或“=”);
②400℃時,反應2NH3(g)?N2(g)+3H2(g)的化學平衡常數為。當測得NH3、N2和H2物質的量分別為3mol、2mol和1mol時,則該反應的v(N2)正v(N2)逆(填“<”、“>”或“=”)。組卷:6引用:2難度:0.6


