2021-2022學(xué)年安徽省六安一中高三(上)第二次月考化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、單項(xiàng)選擇題(本題共14小題,每小題3分,共42分)
-
1.下列有關(guān)水處理方法不正確的是( )
A.用石灰、碳酸鈉等堿性物質(zhì)處理廢水中的酸 B.用可溶性的鋁鹽和鐵鹽處理水中的懸浮物 C.用氯氣處理水中的Cu2+、Hg2+等重金屬離子 D.用食鹽處理含高濃度NH4+的廢水并回收利用氨 組卷:10引用:2難度:0.9 -
2.設(shè)NA為阿伏加德羅常數(shù)的值。下列說法正確的是( )
A.22.4L Cl2溶于足量水,所得溶液中Cl2、Cl-、HClO和ClO-四種微粒總數(shù)為NA B.標(biāo)準(zhǔn)狀況下,38g3H2O2中含有3NA共價(jià)鍵 C.常溫下,將5.6g鐵塊投入足量濃硝酸中,轉(zhuǎn)移0.3NA電子 D.0.1mol?L-1MgCl2溶液中含有的Mg2+數(shù)目一定小于0.1NA 組卷:49引用:5難度:0.7 -
3.中國努力爭取2060年前實(shí)現(xiàn)碳中和。利用NaOH溶液噴淋捕捉空氣中的CO2,反應(yīng)過程如圖所示。下列說法錯(cuò)誤的是( )
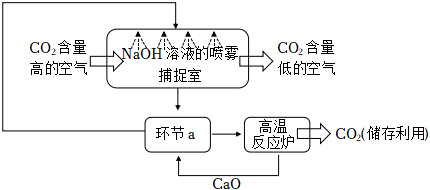
A.捕捉室中NaOH溶液噴成霧狀有利于吸收CO2 B.環(huán)節(jié)a中物質(zhì)分離的基本操作是過濾 C.反應(yīng)過程中CaO和NaOH是可循環(huán)的物質(zhì) D.高溫反應(yīng)爐中的物質(zhì)是Ca(HCO3)2 組卷:0引用:3難度:0.7 -
4.下列反應(yīng)的離子方程式正確的是( )
A.Na2O2與H218O反應(yīng):2Na2O2+2H218O=4Na++4OH-+18O2↑ B.向海帶灰浸出液中加入硫酸、雙氧水:2I-+2H++H2O2=I2+2H2O C.向Na2S2O3溶液中加入足量稀硫酸:2S2O32+4H+=SO42+3S↓+2H2O D.向小蘇打溶液中滴加過量澄清石灰水:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O 組卷:12引用:2難度:0.6 -
5.1mol過氧化鈉與2mol碳酸氫鈉固體混合后,在密閉的容器中加熱充分反應(yīng),排出氣體物質(zhì)后冷卻,殘留的固體物質(zhì)是( )
A.Na2CO3 B.Na2O2 Na2CO3 C.NaOH Na2CO3 D.Na2O2 NaOH Na2CO3 組卷:440引用:67難度:0.7 -
6.下列選項(xiàng)所示的物質(zhì)間轉(zhuǎn)化均能實(shí)現(xiàn)的是( )
A.NaCl(aq) Cl2(aq)電解漂白粉(s)石灰水B.NaCl(aq) NaHCO3(s)CO2(g)Na2CO3(s)加熱C.NaBr(aq) Br2(aq)Cl2(g)I2(aq)NaI(aq)D.Mg(OH)2 MgCl2(aq)HCl(aq)Mg(s)電解組卷:188引用:3難度:0.3
二、非選擇題(本題共5小題,共58分)
-
18.硫酰氯(SO2Cl2)常作氯化劑或氯磺化劑,用于制作藥品、染料、表面活性劑等.其部分性質(zhì)如下表:
回答下列問題:物質(zhì) 熔點(diǎn)/℃ 沸點(diǎn)/℃ 其它性質(zhì) SO2Cl2 -54.1 69.1 ①易水解產(chǎn)生大量白霧
②易分解:SO2Cl2SO2↑+Cl2↑△
I.實(shí)驗(yàn)室合成硫酰氯需要先制取干燥氯氣,制備干燥純凈的氯氣所用儀器如圖1:
(1)上述儀器的連接順序是:e接,接,接,接(按氣流方向,用小寫字母表示).
II.催化合成硫酰氯的實(shí)驗(yàn)裝置如圖 2(夾持儀器已省略):
(2)儀器B冷卻水的進(jìn)口為(填“a””或“b”),活性炭的作用是.
(3)裝置D除干燥氣體外,另一作用是.若缺少D,則硫酰氯會(huì)水解,該反應(yīng)的化學(xué)方程式為.
(4)某同學(xué)建議將收集器A放在冰水中冷卻,你認(rèn)為該同學(xué)的建議是否合理,為什么?
(5)C處U形管中堿石灰的作用是.
III.在氯磺酸中加入四氯化錫加熱煮沸,使氯磺酸分解,可用于制取少量硫酰氯.化學(xué)方程式為:2ClSO3HH2SO4+SO2Cl2,此法得到的產(chǎn)品中混有硫酸.催化劑△
(6)①從分解產(chǎn)物中分離出硫酰氯的方法是.
②請?jiān)O(shè)計(jì)實(shí)驗(yàn)方案檢驗(yàn)產(chǎn)品中硫酸的存在(可選試劑:稀鹽酸、稀硝酸、BaCl2溶液、蒸餾水、石蕊溶液):.組卷:45引用:3難度:0.5 -
19.化學(xué)小組實(shí)驗(yàn)探究SO2與新制氫氧化銅懸濁液的反應(yīng)。
(1)實(shí)驗(yàn)一:試劑瓶丙盛有新制純凈的Cu(OH)2懸濁液,制備SO2(夾持、加熱儀器略),并向丙中通入足量SO2。開始可觀察到丙中局部有淺黃色固體生成,Cu(OH)2全部溶解后得到淡綠色溶液A和少量紫紅色固體B。
①濃H2SO4與Cu片反應(yīng)的化學(xué)方程式是。
②試劑a為。
(2)分析物質(zhì)性質(zhì),紫紅色固體B應(yīng)為單質(zhì)銅。用pH試紙測定淡綠色溶液A的pH約為3,預(yù)測淺黃色固體物質(zhì)為中間產(chǎn)物Cu2O,寫出其生成的化學(xué)反應(yīng)方程式為。(資料:Cu2O酸性條件下不穩(wěn)定,Cu2O+2H+═Cu+Cu2++H2O)
(3)為進(jìn)一步驗(yàn)證SO2與Cu(OH)2懸濁液反應(yīng)過程中產(chǎn)生Cu(Ⅰ)。
實(shí)驗(yàn)二:向CuCl2溶液中加入NaOH溶液至恰好完全反應(yīng),得含NaCl的Cu(OH)2懸濁液,將此懸濁液加入丙中,重復(fù)上述實(shí)驗(yàn)。開始可觀察到局部有淺黃色固體物質(zhì)生成,Cu(OH)2全部溶解后丙底部有較多的白色沉淀C,上層是淡綠色的溶液A。(資料:[Cu(NH3)2]+無色,易被氧化為深藍(lán)色[Cu(NH3)4]2+)
①試管N中加入硝酸銀溶液后生成白色沉淀,證明白色沉淀C中含有的陰離子為;試管M中無色溶液的主要成分為(寫化學(xué)式)。
②C與濃硝酸反應(yīng)的離子方程式為。
(4)解釋實(shí)驗(yàn)二生成白色沉淀C較多,而實(shí)驗(yàn)一生成紫紅色固體B較少的原因?yàn)?。組卷:10引用:2難度:0.5


